
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式__________________________________________
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应。氧化产物为__________
(3)当0.1 mol MnO2参加反应时,转移电子数为____,被氧化的HCl为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
A.元素
B.原子
C.分子
D.单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。郑州一中学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E 是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
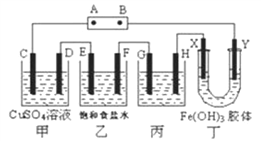
(1)电源B 极的名称是_______________。
(2)甲装置中电解反应的总化学方程式是:______________________。
(3)设电解质溶液过量,则同一时内C、D 电极上参加反应的单质或生成的单质的物质的量之比是________________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质) 精炼,G 极材料应该是___________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是__________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L (标准状况) 时,甲池中所生成物质的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,与盐的水解无关的正确说法是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. 全有关
【答案】D
【解析】①明矾水溶液中,铝离子可水解生成具有吸附性的氢氧化铝胶体,可用作净水剂,故①正确;
②FeCl3溶液中铁离子水解显酸性,加入盐酸可抑制水解,配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸,故②正确;③泡沫灭火剂的灭火原理为NaHCO3和Al2(SO4)3溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳,故③正确;④NH4Cl溶液中铵根离子水解显酸性,NH4Cl+H2ONH3H2O+HCl,加入镁,与盐酸发生反应生成氢气,故④正确;⑤铵根离子和草木灰中的碳酸根离子发生双水解,肥效损耗,草木灰与氨态氮肥不能混合施用,故⑤正确;⑥强酸弱碱盐水解呈酸性,强碱弱酸盐呈碱性,则比较NH4Cl和Na2S等某些盐溶液的酸碱性,是利用盐溶液水解后酸碱性不同,故⑥正确。故选D。
【题型】单选题
【结束】
15
【题目】化工生产中常用MnS作沉淀剂除去Ksp工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A. MnS的Ksp比CuS的Ksp大
B. 该反应达到平衡时c(Mn2+)=c(Cu2+)
C. 往平衡体系中加入少量CuSO4固体后,C(Mn2+)变大
D. 该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。
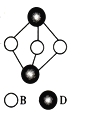
(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
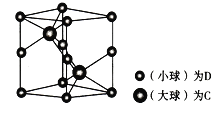
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有各组物质:①O2和O3 ②![]() 和
和![]() ③
③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤  ⑥
⑥ ![]() 和质量数为238、中子数为146的原子 ⑦
和质量数为238、中子数为146的原子 ⑦![]()
请按要求用序号填空:
(1)属于同系物的是___________(2)属于同分异构体是_________(3)属于同位素的是_________(4)属于同素异形体的是________(5)属于同种物质的是___________
II.命名或写出结构简式:
(1) 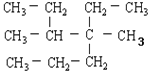 ________________________________
________________________________
(2)2-乙基-1-戊烯 _______________________________
(3)支链上只有一个乙基,且式量最小的烷烃 _________________
【答案】 ④ ⑦ ⑥ ① ⑤ 3,4﹣二甲基﹣4﹣乙基庚烷 CH2=C(CH2CH3)CH2CH2CH3 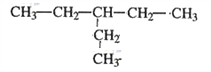
【解析】Ⅰ、同系物是指结构相似,组成上相差1个或者若干个CH2原子团的化合物。具有相同分子式而结构不同的化合物互为同分异构体;质子数相同质量数(或中子数)不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;
①O2和O3是由氧元素组成的不同单质,互为同素异形体;②CH2=CH-CH3和CH2=CH-CH=CH2的结构不同,分子式也不同;③![]() 和
和![]() 分子式不同,结构也不同;④
分子式不同,结构也不同;④![]() 和
和![]() 的结构相似,组成上相差2个CH2,属于同系物;⑤
的结构相似,组成上相差2个CH2,属于同系物;⑤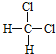 和
和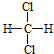 组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与
组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与![]() 的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
故答案为:(1)④;(2)⑦;(3)⑥;(4)①;(5)⑤。
II、(1)烷烃命名时,选最长碳链为主链,从支链最近的一端进行编号;该物质最长碳链含有七个碳,2个-CH3分别在3、4号位,1个乙基在4号位,故命名为:3,4﹣二甲基﹣4﹣乙基庚烷;
(2)2-乙基-1-戊烯,含碳碳双键在内最长碳链有5个碳原子,离双键最近的一端编号,碳碳双键在1号碳,2号碳有一个乙基,据此写出结构简式:CH2=C(CH2CH3)CH2CH2CH3;
(3)支链的长度不能超过其所在位置两侧的主链的长度,烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为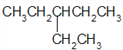 。
。
【题型】综合题
【结束】
24
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com