
| A、铊是易导电的银白色金属 |
| B、铊能生成+3价的离子 |
| C、Tl3+的氧化能力比Al3+强 |
| D、氢氧化铊的碱性比氢氧化铝强 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、+43.5 kJ?mol-1 |
| B、+67.7 kJ?mol-1 |
| C、-43.5 kJ?mol-1 |
| D、-67.7 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸,纯碱(Na2CO3),石灰石 |
| B、醋酸,烧碱(Na OH),硫酸铜 |
| C、硝酸,熟石灰,苛性钾(KOH) |
| D、醋酸,小苏打(NaHCO3),熟石灰(Ca(OH)2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定时,v正>v逆 |
| B、测定时,v正<v逆 |
| C、测定时,v正=v逆 |
| D、不可能达到新平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ag+、NO3-、S2- |
| B、Na+、Al3+、SO42-、HCO3- |
| C、NH4+、K+、OH-、SO42- |
| D、H+、Fe3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
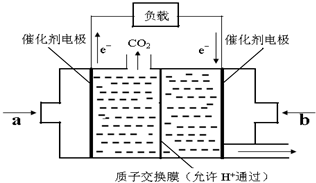 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com