
| A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
分析 A.钙离子与肥皂可生成高级脂肪酸钙沉淀;
B.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成氧气;
C.氯化铵光照条件下不分解;
D.铁粉具有还原性.
解答 解:A.含钙离子浓度较大的地下水与高级脂肪酸钠反应可生成高级脂肪酸钙沉淀,去污能力减弱,故A错误;
B.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,氧气能助燃,所以不能使用泡沫灭火器灭火,故B错误;
C.氯化铵光照条件下不分解,所以NH4Cl不用保存在棕色试剂瓶中,故C错误;
D.铁粉具有还原性,放在食品袋中能够吸收袋中的氧气,所以作脱氧剂,故D正确.
故选D.
点评 本题考查了物质的性质与用途,把握常见物质的性质与用途的关系是解答的关键,侧重化学与生活、生产的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
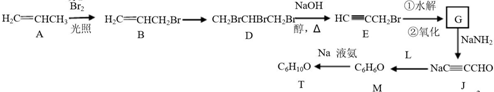
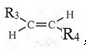 ,则T的结构简式为
,则T的结构简式为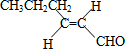 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
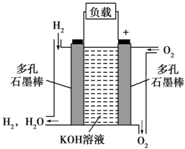 如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)2CHCH3 | C. | (CH3)2CH-CH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1NaHCO3溶液中含有HCO3-数目为NA | |
| B. | 1mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4L乙醇的分子数为NA | |
| D. | 17g H2O2所含共价键的总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com