
| A. | 无色溶液中:Cu2+、K+、NO3-、Cl- | |
| B. | 使pH试纸显红色的溶液中:Fe2+、K+、NO3-、Cl- | |
| C. | 含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+ | |
| D. | 与铝作用生成氢气的溶液中:Mg2+、NO3-、K+、Cl- |
分析 A.Cu2+为蓝色;
B.使pH试纸显红色的溶液,显酸性;
C.该组离子之间不反应;
D.与铝作用生成氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.Cu2+为蓝色,与无色不符,故A错误;
B.使pH试纸显红色的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.与铝作用生成氢气的溶液,为非氧化性酸或强碱溶液,酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,碱溶液中不能大量存在Mg2+,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N2O | B. | NO2 | C. | N2O5 | D. | NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何酸、碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富,仅次于铁 | |
| D. | 工业上通常用钠与铝盐溶液反应来制备铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | (2a-3.2)g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
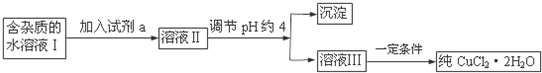
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com