
分析 (1)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据正反应的活化能=逆反应的活化能+反应的焓变;
(2)根据X=2Y,△H=66.88kJ/mol为吸热反应,所以升温平衡正向移动,据此判断;
解答 解:(1)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据正反应的活化能=逆反应的活化能+反应的焓变=23.00kJ/mol+66.88kJ/mol=89.88kJ/mol,答:正反应活化能为89.88kJ/mol;
(2)根据X=2Y,△H=66.88kJ/mol为吸热反应,所以升温平衡正向移动,平衡常数变大,又0℃时,k1=1.60×10-3min-1,所以45℃时k2>1.60×10-3min-1;答:45℃时k2>1.60×10-3min-1.
点评 本题考查了反应活化能的判断计算,以及平衡常数的计算,焓变和活化能计算方法的理解是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
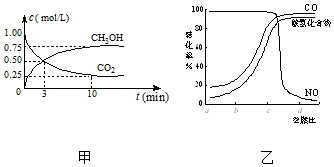 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
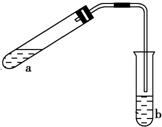 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
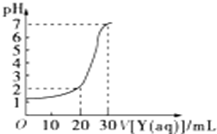 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
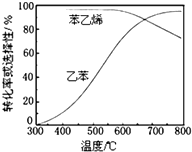 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: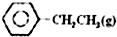 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$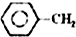 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com