
| A. | 氢硫酸 | B. | 二氧化碳 | C. | 氯化钾 | D. | 醋酸钠 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物;水的电离方程式为H2O?H++OH-,加入的物质或离子能影响水电离平衡的移动,则破坏水的电离,据此分析即可解答.
解答 解:A.氢硫酸为硫化氢的水溶液,为混合物,且抑制水的电离,故A错误;
B.二氧化碳的水溶液能导电,原因是二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,二氧化碳是非电解质,故B错误;
C.氯化钾溶于水电离出氯离子和钾离子能导电,是电解质,向溶液中加入氯化钾,溶液中氢离子浓度和氢氧根离子浓度不改变,则不破坏水的电离,故C错误;
D.醋酸钠在水电离出自由移动的醋酸根和钠离子能导电,醋酸根能与水电离出的氢离子结合生成醋酸,促进水的电离,故D正确;
故选D.
点评 本题主要考查了电解质的概念和影响水的电离因素,掌握电解质必须是自身电离的化合物,加入含弱电解质的离子的物质促进水的电离是解答的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
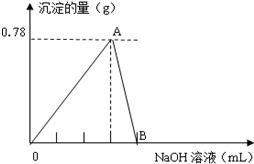
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液由溶质和溶剂组成,所以每种溶液里只有两种物质 | |
| B. | 硫酸钠溶液能导电是因为溶液中含有较多自由移动的离子 | |
| C. | 配置0.09%的生理盐水的一般步骤是计算、称量和溶解 | |
| D. | 在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3与硫酸反应的实验中,实验室没有硫酸,临时用硝酸进行实验 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在加热下反应,并用排水集气法收集 | |
| D. | 配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石空间网状结构中,由共价键形成的碳原子环中,最小环为6元碳环 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻8个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、OH-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、H+、SO42-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 10:7 | D. | 任意比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com