
分析 工业上利用氮气合成硝酸的反应为氮气和氢气在高温、高压、催化剂作用下反应生成氨气,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,据此书写该化学方程式.
解答 解:工业上利用氮气合成硝酸的反应为氮气和氢气在高温、高压、催化剂作用下反应生成氨气,反应的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:2NO+O2=2NO2,二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO;
点评 本题考查了硝酸工业制备主要是化学方程式书写,题目难度不大,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 硫酸铝溶液中加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓ | |
| C. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| D. | 氯化铝溶液中加入过量氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g 氧气所含的原子数为NA | |
| B. | 1.8 g NH4+中含有的质子数NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为3NA | |
| D. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
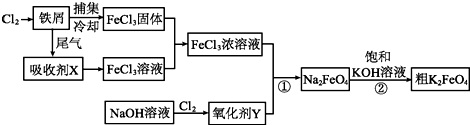
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
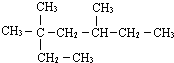 的系统命名法的名称3,3,5,-三甲基庚烷
的系统命名法的名称3,3,5,-三甲基庚烷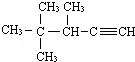 的系统命名法的名称为3,4,4-三甲基-1-戊炔.
的系统命名法的名称为3,4,4-三甲基-1-戊炔. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料的脱硫脱氮、SO2的回收利用和NOX的催化转化都是减少酸雨产生的措施 | |
| B. | 用FeCl2溶液与铜反应制作印刷电路板 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 碳酸钠治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用油脂水解制备甘油 | |
| B. | 食用油反复加热会产生芳香族化合物等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 糖、油脂、蛋白质都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠中约含有6.02×1023个氯化钠分子 | |
| B. | 常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA | |
| C. | 0.1molNa2O2与足量的水反应,转移电子数为0.2NA | |
| D. | 200mL 0.5 mol•L-1的Na2CO3溶液中CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com