
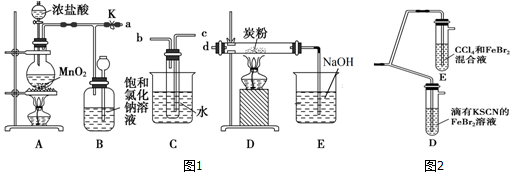
分析 (1)分析装置D中反应,反应物有C、Cl2,生成物有CO2、HCl,显然反应物中缺少O、H两种元素,C的作用的提供水蒸气,连接方式应选择能让Cl2带走更多水蒸气的方式,气体通过盛有水的试管时应长进短出;
(2)根据反应物和生成物,结合质量守恒定律书写化学方程式;利用浓硫酸溶于水放热的性质分析;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)依据氧化性强的能够制备氧化性弱的结合D、E中的现象判断三种物质的氧化性强弱顺序,氯气有毒,尾气直接排放到空气中能引起环境污染.
解答 解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,
故答案为:c,b;
(2)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,C为提供水蒸气的装置,加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,
故答案为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2;加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)依据D装置中:溶液变红;E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,可知氯气少量只氧化二价铁离子,可知溴离子的还原性弱于二价铁离子,则溴单质的氧化性强于三价铁离子,氯气的氧化性强于溴,所以Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+;氯气有毒,尾气直接排放到空气中能引起环境污染,所以缺少尾气处理装置;
故答案为:Cl2>Br2>Fe3+;缺少尾气处理装置.
点评 本题考查了氯气的制备及性质的检验,明确氯气制备原理及化学性质是解题关键,注意氧化还原反应强弱规律及判断方法,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙炔 | B. | 1,3-丁二烯 | C. | 环己烷 | D. | 乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
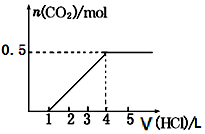 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A. | 通入的CO2气体为11.2 L | B. | A溶液中n(NaHCO3)=2n(Na2CO3) | ||
| C. | A溶液中既含NaOH,又含Na2CO3 | D. | A溶液中一定只有Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
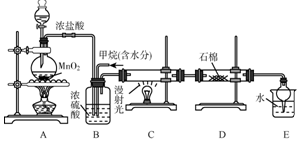 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com