
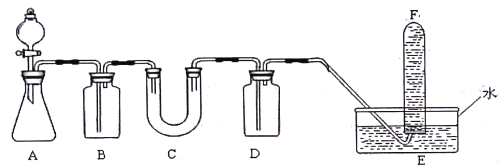
【题目】化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。

(1)装置A中制取Cl2的化学方程式为________________________。
(2)装置C中发生反应的离子方程式为_________________,反应后溶液中含Cl元素的分子有_________。
(3)实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 _____________ 。
(4)装置F的作用是______,该装置中发生反应的离子方程式______________。
【答案】 MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+ H2O =H++Cl- +HClO Cl2、HC1O Cl2+ H2O + SO32-= SO42 -+Cl-+ 2H+ 吸收多余的Cl2,防止环境污染 Cl2 +2OH-= H2O +Cl + ClO-
MnCl2+Cl2↑+2H2O Cl2+ H2O =H++Cl- +HClO Cl2、HC1O Cl2+ H2O + SO32-= SO42 -+Cl-+ 2H+ 吸收多余的Cl2,防止环境污染 Cl2 +2OH-= H2O +Cl + ClO-
【解析】装置A是氯气发生装置,生成的氯气含水蒸气和氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通过装置C吸收氯气形成氯水,通过装置D中亚硫酸钠和氯气反应氧化还原反应生成硫酸钠,E装置是收集氯气,F装置是吸收剩余氯气。
(1)装罝A中制取Cl2的化学方程式为MnO2 +4HCl(浓)![]() MnCl2+C12↑+2H2O;(2)氯气和水反应生成氯化氢和次氯酸,次氯酸为弱酸,装罝C中发生反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,反应后溶液中含有的具有氧化性的含Cl元素的分子有 Cl2、HClO;(3)氯气将亚硫酸根离子氧化成硫酸根离子,氯气被还原为氯离子,Cl2通过装置D溶液时发生反应的离子方程式为:Cl2+H2O+SO32-═SO42-+2Cl-+2H+;(4)氯气有毒,装置F的作用是吸收多余的Cl2,防止环境污染,反应的离子方程式为:Cl2+2OH-═H2O+Cl-+ClO-。
MnCl2+C12↑+2H2O;(2)氯气和水反应生成氯化氢和次氯酸,次氯酸为弱酸,装罝C中发生反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,反应后溶液中含有的具有氧化性的含Cl元素的分子有 Cl2、HClO;(3)氯气将亚硫酸根离子氧化成硫酸根离子,氯气被还原为氯离子,Cl2通过装置D溶液时发生反应的离子方程式为:Cl2+H2O+SO32-═SO42-+2Cl-+2H+;(4)氯气有毒,装置F的作用是吸收多余的Cl2,防止环境污染,反应的离子方程式为:Cl2+2OH-═H2O+Cl-+ClO-。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】在3种物质①醋酸、②氧化铁、③氨气中,可用作红色颜料的是___________(填序号,下同),可用做制冷剂的是__________,可清除水壶中水垢的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸变蓝色的有 ( )
①加热浓氨水 ②加热NH4Cl固体 ③加热NH4Cl和Ca(OH)2的混合物 ④加热饱和NH4Cl溶液
A. ②④ B. ③④ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断一定正确的是( )
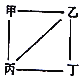
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期ⅠA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )。
A. 在已知碱金属元素中具有最大的原子半径
B. 在空气中燃烧时生成氧化物Fr2O
C. 氧化物对应的水化物是极强的碱
D. 其单质的熔点比金属钠的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)![]() 4PCl3(g) ΔH=a kJ·mol1,
4PCl3(g) ΔH=a kJ·mol1,
P4(g)+10Cl2(g)![]() 4PCl5(g) ΔH =b kJ·mol1,
4PCl5(g) ΔH =b kJ·mol1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol1,PCl3中P—Cl键的键能为1.2c kJ·mol1。下列叙述正确的是
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)![]() PCl5(s)的反应热ΔH
PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为(ba+5.6c)/4 kJ·mol1
D.P—P键的键能为(5a3b+12c)/8 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供养剂。请选择适当的化学试剂和实验 用品,用下图中的实验装置进行试验,证明过氧化钠可作供养剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:__________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入试剂的目的 |
B | 饱和NaHCO3溶液 | ____________ |
C | _________________ | ____________ |
D | _________________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取l0mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取l0mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验l后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。

回答下列问题:
(1)原溶液中不存在的离子有________,存在的离子有___________________。
(2)实验3中,图像中OA段反应的离子方程式为___________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)滤液A的主要成分________(填写化学式),滤液B中所含金属阳离子为_________。
(2)反应①的离子方程武是_________________________________。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是__________________。
(4)反应②的化学反应方程式是____________________________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com