
 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
分析 (1)原电池负极发生氧化反应,由电池反应式可知,Zn失去电子生成[Zn(NH3)2]2+,可知需要NH4+参与反应,结合原子守恒与电荷守恒可知有H+生成;
(2)正极会生成氢气,加热或充电可能发生爆炸危险;
(3)I.滤液中含有氯化铵,加入氢氧化钠溶液加热生成的气体为NH3,氨气可以使湿润的红色石蕊试纸变蓝;
白色沉淀部分转化为红褐色沉淀,即氢氧化锌与铁离子反应达到氢氧化铁沉淀,说明氢氧化锌的溶度积大于氢氧化铁的溶度积;
Ⅱ.应保持装置内外气体压强相等,可以上下移动右管,使两管液面保持同一高度;实验1中MnO2的作用是催化剂,实验2中又加入硫酸,生成气体体积增大,且为实验1中的2倍,说明二氧化锰不是催化剂,实验1中过氧化氢分解时发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,可知实验2中过氧化氢中氧元素全部被氧化为氧气,二氧化锰起氧化剂作用;
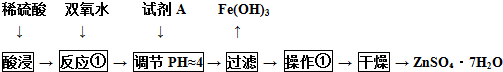
(4)酸浸时硫酸与Zn、Fe反应生成硫酸锌、硫酸亚铁,加入过氧化氢将亚铁离子氧化为铁离子,加入试剂A调节溶液pH使铁离子转化为氢氧化铁沉淀,过滤除去,不能引入新杂质,A可以为ZnO、Zn(OH)2、ZnCO3,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到七水合硫酸锌;
(5)浓硫酸增重为分解生成水的质量,碱石灰增重为分解得到二氧化碳的质量,结合原子守恒计算碳酸根、氢氧根的物质的量,再结合电荷守恒计算Zn2+的物质的量,计算X、Y、Z的比例关系确定化学式.
解答 解:(1)原电池负极发生氧化反应,由电池反应式可知,Zn失去电子生成[Zn(NH3)2]2+,可知需要NH4+参与反应,结合原子守恒与电荷守恒可知有H+生成,负极电极反应式为:Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+,
故答案为:Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+;
(2)正极会生成氢气,加热或充电可能发生爆炸危险,
故答案为:有可能发生爆炸;
(3)I.滤液中含有氯化铵,加入氢氧化钠溶液加热生成的气体为NH3,检验氨气的方法为:将湿润的红色石蕊试纸靠近试管口,试纸变蓝,
白色沉淀部分转化为红褐色沉淀,即氢氧化锌与铁离子反应达到氢氧化铁沉淀,说明氢氧化锌的溶度积大于氢氧化铁的溶度积,反应离子方程式为:3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq),
故答案为:将湿润的红色石蕊试纸靠近试管口,试纸变蓝;大于;3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq);
Ⅱ.为了准确读取量气管读数,读数时视线应与左管凹液面最低处相平,还应注意:读数前上下移动右管,使两管液面保持同一高度;
实验1中MnO2的作用是催化剂,实验2中又加入硫酸,生成气体体积增大,且为实验1中的2倍,说明二氧化锰不是催化剂,实验1中过氧化氢分解时发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,可知实验2中过氧化氢中氧元素全部被氧化为氧气,二氧化锰起氧化剂作用,反应离子方程式为:H2O2+2H++MnO2=Mn2++2H2O+O2↑,
故答案为:读数前上下移动右管,使两管液面保持同一高度;H2O2+2H++MnO2=Mn2++2H2O+O2↑;
(4)酸浸时硫酸与Zn、Fe反应生成硫酸锌、硫酸亚铁,加入过氧化氢将亚铁离子氧化为铁离子,加入试剂A调节溶液pH使铁离子转化为氢氧化铁沉淀,过滤除去,不能引入新杂质,A可以为ZnO、Zn(OH)2、ZnCO3,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到七水合硫酸锌,操作①过程中所需的仪器有酒精灯、玻璃棒、漏斗和蒸发皿、小烧杯,
故答案为:ZnO等;蒸发浓缩;bd;
(5)浓硫酸增重为分解生成水的质量,水的物质的量为$\frac{0.72g}{18g/mol}$=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到二氧化碳的质量,二氧化碳物质为$\frac{0.88g}{44g/mol}$=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=$\frac{1}{2}$×(0.08mol+0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3(CO3)(OH)4,
故答案为:Zn3(CO3)(OH)4.
点评 本题比较综合,涉及原电池、元素化合物性质、离子检验、沉淀转化、化学工艺流程、物质的分离提纯、物质组成测定等,(1)中可以利用总反应式减去正极反应式得到负极反应式,需要学生具备扎实的基础与灵活运用的能力.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:填空题
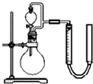
 中和热的测定实验(如图).
中和热的测定实验(如图).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可长期存放碱性食物 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 过氧化钠用作呼吸面具中的供氧剂 | D. | 氯气用于农药的生产和药物合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 | |
| B. | 反应Hg(1)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时增大氮气的浓度,正逆反应速率均增大,平衡正向移动,氢气的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

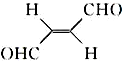 ,下列叙述正确的有AD.
,下列叙述正确的有AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2为分子晶体,Si为原子晶体 | |
| B. | Si是光导纤维的主要成分 | |
| C. | 在该反应条件下,C的氧化性强于Si的氧化性 | |
| D. | 每生成1 mol Si理论上转移的电子数目约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H>0 | |
| C. | 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值增大 | |
| D. | 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 常温常压下,3.2gO2和3.2gO3中所含氧原子数都是0.2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,其体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com