
【题目】已知反应3A(g)+B(g)![]() C(s)+4D(g) △H﹤0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度②升高反应温度③缩小反应容器的体积(加压)④加入催化剂
C(s)+4D(g) △H﹤0,如图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度②升高反应温度③缩小反应容器的体积(加压)④加入催化剂
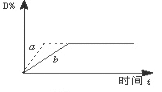
A. ①② B. ①③ C. ③④ D. ②③
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。请回答下列问题:
(1)烃A的分子式为________。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为________________。
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为___________。
(4)比A少两个碳原子的A的烯烃同系物的同分异构体共有________种,其中只含有一个甲基的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),2min末生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1molL﹣1 min﹣1,试计算(写出计算过程)
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A. 加入催化剂可加快该反应的速率,从而提高SO2的转化率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,故温度越低,对提高SO3的日产量越有利
D. 在2min时间内,SO2的浓度由6 mol/L变为3 mol/L,则在相同时间段内,SO3(g)生成的平均速率为1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___molL﹣1s﹣1。
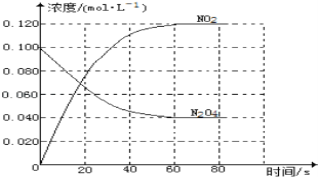
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
A. 乙烯→乙二醇: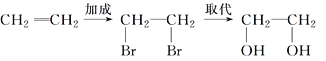
B. 溴乙烷→乙醇:CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2OH
CH3CH2OH
C. 1-溴丁烷→1-丁炔:CH3CH2CH2CH2Br![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]()
![]()
![]() CH3CH2C≡CH
CH3CH2C≡CH
D. 乙烯→乙炔:CH2=CH2![]()
![]()
![]() CH≡CH
CH≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不能使酸性KMnO4溶液褪色的是
①![]() ②
②![]() ③
③![]() ④CH3CH2OH ⑤CH2=CH-COOH
④CH3CH2OH ⑤CH2=CH-COOH
A. ①③B. ①②③C. ③④⑤D. ②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com