
在一个绝热的体积一定的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )
2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )
A.体系的压强不再改变
B.体系的温度不再改变
C.断裂1 mol N≡N键的同时,也断裂6 mol N—H键
D.反应消耗的N2、H2与产生的NH3的速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
A.1 mol·L-1 NaCl溶液含有NA个Na+
B.1 mol Cu和足量稀硝酸反应产生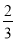 NA个NO分子
NA个NO分子
C.1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O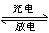 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
(6 分)二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
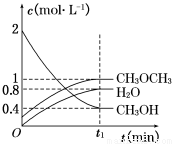
(1)该条件下反应平衡常数表达式K=________。在T1℃时,反应的平衡常数为________;
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下列事实不能说明一元酸HA为弱酸的是( )
A.常温下0.1 mol·L-1的HA溶液pH为5
B.常温下NaA溶液的pH>7
C.HA溶液中存在H+、OH-、A-、HA
D.HA溶液能与大理石反应
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+ O2(g)
O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1
2SO3(l)ΔH=-196.6 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1
SO3(g)ΔH=-78.64 kJ·mol-1
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1
2SO3(g)ΔH=+196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:填空题
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。
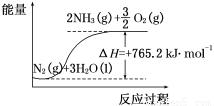
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O
⑤杂质碳被氧化
A.只有①和② B.只有②③④
C.①②③④ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com