
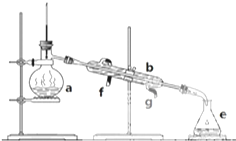
 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
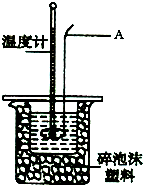 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
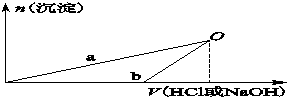 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100ml稀盐酸 |
| NaOH溶液 |
| 100mlNaOH溶液 |
| 稀盐酸 |
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1KNO3溶液:H+、Fe 2+、SCN -、SO42- | ||
| B、pH=0的溶液:Al3+、Cu(NH3)42+、F -、SO42- | ||
| C、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

 和
和
 和
和
 (环戊烷)
(环戊烷)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com