
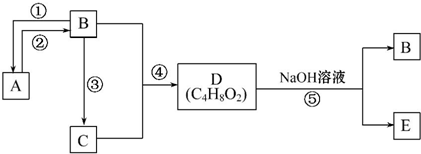
分析 A是乙烯,B、C、D、E均为常见的有机物,由转化关系可知,B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,E为CH3COONa.
解答 解:A是乙烯,B、C、D、E均为常见的有机物,由转化关系可知,B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,E为CH3COONa.
(1)C的结构简式是:CH3COOH,故答案为:CH3COOH;
(2)乙醇、乙酸能与金属钠反应放出氢气,故答案为:BC;
(3)乙烯与水发生加成反应生成乙醇,乙醇发生消去反应生成乙烯,乙醇发生氧化反应生成乙酸,乙酸发生水解反应,故答案为:③;
(4)A、B、C三种物质的摩尔质量由大到小的顺序是:乙烯<乙醇<乙酸,故答案为:乙烯<乙醇<乙酸;
(5)反应⑤的化学方程式是:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
点评 本题考查有机物推断,涉及烯烃、醇、羧酸、酯的性质与转化,熟练掌握有机物的性质,比较基础.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 9% | C. | 14.3% | D. | 17.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
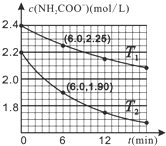 已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A. | 无法判断T1和T2的大小关系 | |
| B. | T1℃时,第6min反应物转化率为6.25% | |
| C. | T2℃时,0~6min ν(NH2COO-)=0.3mol•L-1•min-1 | |
| D. | 往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com