
分析 (1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH;
(2)①CH3COONa的水解平衡常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$;25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,据此计算NH3•H2O的电离常数Ka并离子浓度大小;
(3)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,溶液中存在物料守恒.
解答 解:(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③,
故答案为:①②⑥⑤④③;
(2)CH3COONa的水解平衡常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10;
25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(NH4+)=c(CH3COO-),则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3•H2O的电离常数Ka=1.7×10-5mol/L,该溶液中离子浓度大小为:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:5.9×10-10;1.7×10-5mol/L;c(NH4+)=c(CH3COO-)>c(H+)=c(OH-);
(3)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L,
故答案为:0.5mmol/L;>.
点评 本题考查了弱电解质的电离,涉及pH大小的判断、酸碱混合溶液定性判断等知识点,明确物质的性质及弱电解质电离特点是解本题关键,难点是(2),会根据微粒间的关系进行公式转换,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 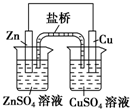 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 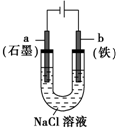 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 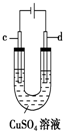 用装置精炼铜时,c极为粗铜 | |
| D. | 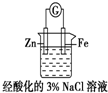 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
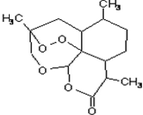 青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )
青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )| A. | 分子式是C15H22O5 | |
| B. | 易溶于水,乙醇和乙醚 | |
| C. | 含有-O-O-键,具有较强的氧化性 | |
| D. | 1mol青蒿素可以和1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
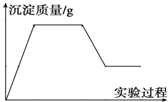 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com