
【题目】某温度下,可逆反应mA(g)+nB(g)![]() pC(g)的平衡常数为K,下列对K的说法正确的是( )
pC(g)的平衡常数为K,下列对K的说法正确的是( )
A.K值越大,表明该反应越有利于C的生成
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)是一种常见颜料,用废铁屑制取铁红的工艺如图:

(1)写出废铁屑中的铁和稀硫酸反应的离子方程式:_____。
(2)“沉淀”反应中除生成FeCO3外,还生成一种能使澄清石灰水变浑浊的气体,该气体为_____。
(3)检验滤液中含有![]() 的方法是_____。
的方法是_____。
(4)“煅烧”时FeCO3与O2反应的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:Mg5Al3(OH)19(H2O)4![]() H2O↑+MgO+A12O3
H2O↑+MgO+A12O3
(1)请配平方程式_______________________。
(2)写出该化合物作阻燃剂的两条依据______。
(3)已知MgO可溶于NH4Cl的水溶液,其原理为______(用化学方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
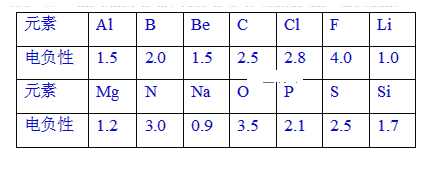
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲用NH4C1与Ca(OH)2反应制取NH3,则甲中的气体发生装置___________(从Ⅱ中选用);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为__________
(2)装置丙用于收集NH3,应将导管__________(填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为__________,装置己的作用为____________(答两点)。
(3)若装置丁中黑色固体变红,则装置戊中现象为_________
(4)研究小组的同学通过讨论、分析后认为充分反应后生成的红色固体可能是Cu或Cu2O或二者的混合物,通过查阅资料知:Cu2O+2H+=Cu+Cu2++H2O。为探究固体的成分,提出了如下两种方案。
I. 甲同学取少量红色固体与稀硝酸混合,最终得到蓝色溶液,由此推测红色产物中有Cu2O。
①你对甲同学实验设计的评价是__________(请给出必要的文字解释)。
②Cu2O与稀硝酸反应的离子方程式为_____________
Ⅱ.乙同学认为不需要借助任何化学试剂,只需要称量生成的红色固体的质量(设为xg)就能确定产物成分,当x取值范围为 _____时,表明产物中既有Cu,又有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
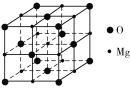
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为___nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molN2与3molH2混合充入2L的恒容密闭容器中,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
A.反应速率v(NH3)=0.3mol/(L·min)B.2min时,c(N2)=0.7mol/L
C.2min时,H2的转化率为30%D.2min时,气体压强变为反应前的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮是主要的大气污染物之一,工业上在一定条件下用NH3可将NO2还原。文宏同学在实验室对该反应进行了探究。实验设计如下(部分夹持装置省略):

回答下列问题:
(1)用装置A制备NH3,其中发生反应的化学方程式为________________;装置B内的试剂是______________
(2)装置D中发生反应的离子方程式是_________________,铜丝可抽动的优点是________________。
(3)NH3和NO2在M中充分反应后,产生两种对环境友好的物质,该反应的化学方程式为________________,M中可观察到的现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com