
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
分析 如果两者直接相连,如果电解质溶液为酸,则石墨电极上可能发生2H++2e-═H2↑;如果电解质是中性或弱酸性发生吸氧腐蚀,则石墨电极上可能发生:O2+2H2O+4e-═4OH-;如果石墨极接直流电源的正极,电解质为硫酸钠溶液,则阳极发生4OH-═O2+2H2O+4e-,由此分析解答.
解答 解:如果两者直接相连,如果电解质溶液为酸,则石墨电极上可能发生2H++2e-═H2↑;如果电解质是中性或弱酸性发生吸氧腐蚀,则石墨电极上可能发生:O2+2H2O+4e-═4OH-;如果石墨极接直流电源的正极,电解质为硫酸钠溶液,则阳极发生4OH-═O2+2H2O+4e-,所以①②③都可以发生,
故选D.
点评 本题考查原电池和电解池原理,根据电极上得失电子来分析解答,明确原电池的工作原理及电解质溶液的性质是解答本题的关键,电解过程的反应原理应用,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4 种 | B. | 6 种 | C. | 8 种 | D. | 10 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒压容器中,反应A(s)+2B(g)?2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 | |
| B. | 恒温恒容容器中,通入一定量的N2O4,反应N2O4?2NO2(g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大 | |
| C. | 恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)?2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 | |
| D. | 恒温恒容容器中,N2(g)+3H2(g)?2NH3(g)达平恒后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
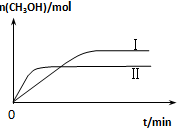 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
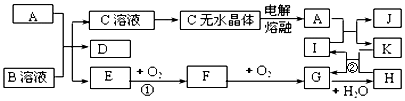
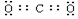 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.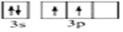 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com