
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| D. | 常温下,0.2 mol•L-1 NH4NO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
分析 A.混合后的溶液中存在物料守恒,n(Na)=n(CH3COO-)+n(CH3COOH),2n(Ca)=n(Cl-);
B.浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合得到碳酸钠溶液,碳酸钠溶液中存在电荷守恒和物料守恒,据此计算分析判断;
C.pH相同的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相同,则c(NH4+)=c(K+)=2c(Ba2+);
D.常温下,0.2 mol•L-1 NH4NO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中含等浓度的NH4NO3、NH3•H2O、NaNO3.
解答 解:A.混合后的溶液中存在物料守恒,n(Na)=n(CH3COO-)+n(CH3COOH),2n(Ca)=n(Cl-),则c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故A正确;
B.浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合得到碳酸钠溶液,溶液中电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),代入计算得到c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B错误;
C.pH相同的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相同,则c(NH4+)=c(K+)=2c(Ba2+),故C正确;
D.常温下,0.2 mol•L-1 NH4NO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中含等浓度的NH4NO3、NH3•H2O、NaNO3,一水合氨电离大于铵根离子水解溶液显碱性,溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选AC.
点评 本题考查了电解质溶液中物料守恒、电荷守恒的分析应用,注意反应后的产物分析判断和溶液离子浓度大小比较,题目难度中等.


科目:高中化学 来源: 题型:解答题
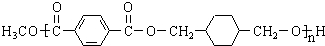 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.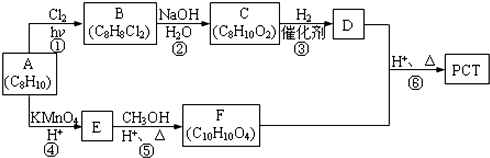
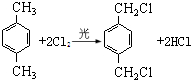 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.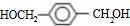 ,反应③的类型是加成反应,
,反应③的类型是加成反应,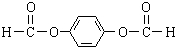 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
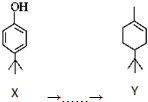 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 化合物Y中含有1个手性碳原子 | |
| B. | 用FeCl3溶液可鉴别化合物X和Y | |
| C. | 1molX与溴水反应最多消耗1molBr2 | |
| D. | 在一定条件,化合物X、Y均可以发生缩聚反应和加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
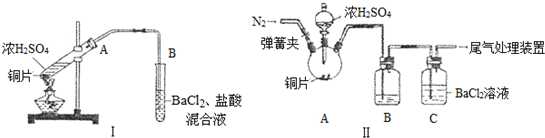
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①②④ | C. | 只有①③⑤ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | X的氢化物沸点一定比Z的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
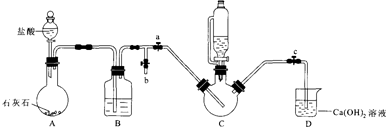
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com