海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的过程如下:
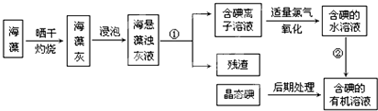
请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是
.
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①
、②
.
(3)提取碘的过程中,不能使用的有机溶剂是
.其原因是
.
A.酒精 B.苯 C.汽油
该提取操作通常在
(仪器名称)中进行,若得到的是含碘的四氯化碳溶液,静置后分层,下层为
色.
(4)设计一个简单的实验,检验提取碘后的水溶液中是否还含有单质碘.请写出该实验的实验步骤、现象及结论
.
(5)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
(Ⅰ)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO
3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10
-3mol/L的Na
2S
2O
3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是
mg/kg.(以含w的代数式表示).
(已知:KIO
3+5KI+3H
2SO
4=3K
2SO
4+3I
2+3H
2O;I
2+2S
2O
32-=2I
-+S
4O
62-.)
(Ⅱ)学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示
.
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
.




 下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表一部分,表中所列字母分别代表某一化学元素.