
| A. | H2O<HF | B. | SiCl4>CCl4 | C. | HCl>HF | D. | N2>CO |
分析 分子晶体是分子间通过分子间作用力(范德华力和氢键)构成的晶体,由于范德华力和氢键,作用力小,所以分子晶体的熔沸点比较低,硬度小.
解答 解:A.常温下水是液体,HF是气体,所以沸点水大于HF,故A错误;
B.分子结构相似的物质,若不存在氢键,其相对分子质量越大,熔沸点越高,故B正确;
C.由于HF中存在氢键,所以HF的熔沸点高于HCl,故C错误;
D.由于C-O单键的键长小于氮气中N-N的键长,故熔沸点氮气小于CO,故D错误,故选B.
点评 本题考查晶体熔沸点高低判断,明确晶体类型及影响晶体熔沸点高低的因素是解本题关键,知道离子晶体中晶格能的影响因素,熟练掌握碱金属族、卤族中性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
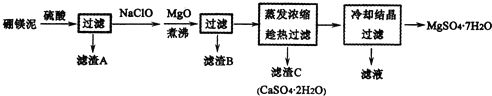
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
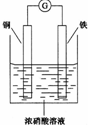 HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:
HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B形成的化合物中只含离子键 | |
| B. | A的气态氢化物的沸点一定高于D的气态氢化物的沸点 | |
| C. | 若A与C的原子序数相差5,则二者形成化合物的化学式一定为C2A3 | |
| D. | 相同条件下,B的最高价氧化物的水化物的碱性比C的最高价氧化物的水化物的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
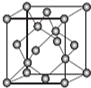 AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常用小黑点来表示电子的多少,黑点密度大,电子数目大 | |
| B. | 黑点密度大小,表示单位体积内电子出现的机会多少 | |
| C. | 通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 电子云图是对运动无规律性的描述 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com