
| A. | 电解质一定是化合物 | B. | 电解质可以是混合物 | ||
| C. | 电解质不一定是化合物 | D. | 电解质一定是单质 |
科目:高中化学 来源: 题型:解答题
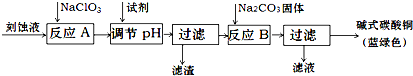
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能自发进行 | B. | 不能自发进行 | ||
| C. | 可能自发进行 | D. | 在加热条件下才能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 臭氧层吸收太阳紫外线,反应3O2=2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们所含氧原子数目之比为2:3 | B. | 它们的体积之比为1:1 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的分子数目之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
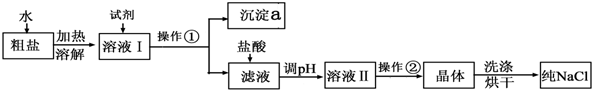

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com