
【题目】以下是有关SO2、Cl2的性质实验。
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
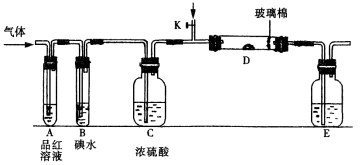
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.硝酸钠溶液 C.氯化钙溶液
若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
【答案】
(1)①相同;Cu粉红热,并产生棕黄色烟;2SO2 + O2![]() 2SO3;
2SO3;
②SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-;③NaOH;
(2)A B;(3)4Cl2 + S2O32-+ 5H2O = 2SO42-+ 8Cl-+ 10H+;
【解析】
试题分析:(1)①二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;铜粉在Cl2中加热Cu粉红热,并生成产生棕黄色烟氯化铜;二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应生成三氧化硫,反应方程式为 2SO2+O2 ![]() 2SO3,故答案为:相同;Cu粉红热,并产生棕黄色烟;2SO2+O2
2SO3,故答案为:相同;Cu粉红热,并产生棕黄色烟;2SO2+O2 ![]() 2SO3;
2SO3;
②SO2通入B装置碘水中,溶液颜色退去,发生了氧化还原反应:碘单质具有氧化性,二氧化硫具有还原性,被碘单质氧化为硫酸,本身被还原为碘化氢,反应的离子方程式为:SO2+I2+2H2O=4H++2I-+SO42-,故答案为:SO2+I2+2H2O=4H++2I-+SO42-;
③E为尾气处理,吸收多余的SO2和Cl2应盛有氢氧化钠溶液,故答案为:NaOH;
(2)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应:A、氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,故A正确;B、硝酸钠溶液中含有硝酸根离子,通入二氧化硫后,溶液显酸性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,故B正确;C.氯化钙溶液和二氧化硫不反应,故C错误;故答案为:AB
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为![]() :
:![]() =3:2,所以该离子为S2O3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,故答案为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+。
=3:2,所以该离子为S2O3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,故答案为:4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+。


科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
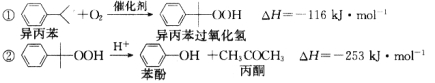
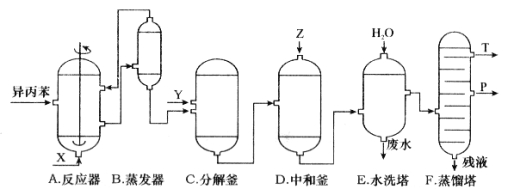
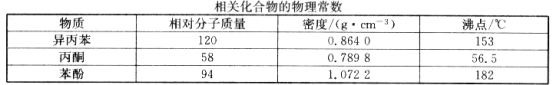
回答下列问题:
(1)在反应器 A 中通入的 X 是 。
(2)反应①和②分别在装置 和 中进行。(填装置符号)
(3)在分解釜 C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度应控制在 50~60℃,温度过高的安全隐患是 。
(5)中和釜 D 中加入的 Z 最适宜的是 (填序号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。


请回答:
(1)铝在周期表中位于 周期 族。
(2)步骤Ⅰ进行的实验操作的名称是 。
(3)写出步骤Ⅱ反应中生成C的离子方程式: 。
(4)进行步骤Ⅱ时,该小组 用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式: ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 。
(6)用途径②制备CuSO4溶液与途径①、③相比优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
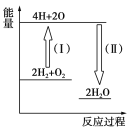
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室需要450 mL 0.02 mol/L酸性KMnO4标准溶液,现有仪器:
① 托盘天平 ② 玻璃棒 ③ 药匙 ④ 200mL烧杯 ⑤ 量筒,还需要 玻璃仪器才能完成配制,需称量KMnO4固体 g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是 (填写编号,假设其他操作均正确)。
A.没有冷却至室温就转移液体到容量瓶并完成定容 |
B.使用容量瓶配制溶液,定容时,俯视刻度线 |
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中 |
D.容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液 |
E.定容时,滴加蒸馏水,不慎液面略高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)配平下面的方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□H2C2O4+□H2SO4——□MnSO4+□K2SO4+□H2O+□CO2↑
(4)人体血液里Ca2+的浓度一般以mg/cm3为单位。为测定血液样品中Ca2+的浓度,抽取血样20.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用上述标准0.02 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗13.00 mL酸性 KMnO4溶液,请计算血液样品中Ca2+的浓度为_________mg/cm3(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是

A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有两种气态烷烃的混合物,在标准状况下密度为1.16gL﹣1,则下列关于此混合物组成中一定含有的烃是的化学式是 .该烃和氯气在光照下反应生成的有机物共有 种,其中 (填写化学式)在常温下呈气态.
(2)燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0g,再将剩余气体通过澄清石灰水,生成沉淀40g.据此求烃的分子式,并写出该烃可能的结构简式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com