
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 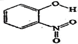 | 0.2 | 45 |
| B | 对-硝基苯酚 | 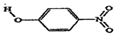 | 1.7 | 114 |
分析 (1)前三周期元素中Na最容易失去第一电子,故Na的第一电离能最小;1s22s22p63s1;氢化物中两种元素非金属性差别越大,化学键极性越大;HF为极性分子且在水中能与水形成氢键,所以在水中溶解度大于在CCl4中的溶解度;
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大;非金属性越强,半径越小,共价键键能越大.
(4)A.原子晶体半径越小,熔点越高;
B.结构相似的分子晶体分子量越大熔点越高;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答 解:(1)前三周期元素中Na最容易失去第一电子,故Na的第一电离能最小,由电子排布式的书写规律可以写出Na的排布式为1s22s22p63s1,氢化物中两种元素非金属性差别越大,化学键极性越大,HF为极性分子且在水中能与水形成氢键,所以在水中溶解度大于在CCl4中的溶解度,
故答案为:Na;1s22s22p63s1;HF;小;
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键,故选B;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大,则晶格能的大小:MgO>NaCl,非金属性越强,半径越小,共价键键能越大,则键能的大小:HBr
>HI,
故答案为:>;>;
(4)A.原子半径N<C<Si,原子晶体半径越小,键能越大,则熔点越高,故A错误;
B.结构相似的分子晶体分子量越大,分子间作用力越强,则熔点越高,故B正确;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体,故C错误;
故答案为:B.
点评 本题考查了分子晶体、离子晶体、原子晶体的熔沸点的比较,以及相似相溶原理,氢键等知识.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
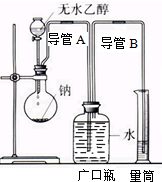 为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:
为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③④ | B. | 只有①②④ | C. | 只有②③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
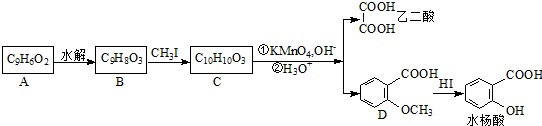
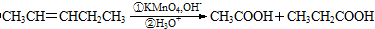
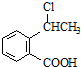
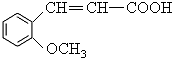 .
. 可以最终合成芳香内酯A,其中前两步的反应是
可以最终合成芳香内酯A,其中前两步的反应是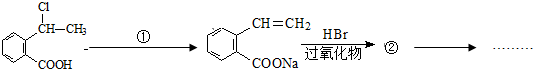
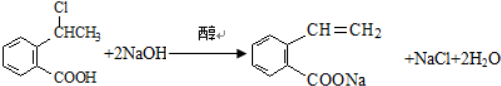 ,产物②的结构简式是
,产物②的结构简式是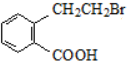 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>c>b | B. | a=b=c | C. | a=c>b | D. | a>c=b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com