
【题目】某澄清溶液中含有下表离子中的一种或多种。分别取它的水溶液两份进行实验,结果如下:
阳离子 | Fe2+、Fe3+、Al3+ |
阴离子 | SO32-、CO32-、SiO32-、I-、NO3- |
①向一份溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清;
②继续向①溶液中加入少许四氯化碳,震荡,静置,下层呈现紫红色,上层溶液呈现黄色;
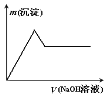
③向另一份溶液中加入过量氢氧化钠溶液,产生沉淀的质量与加入碱液的体积关系如图所示。
根据以上信息,回答下列问题:
(1)原溶液中肯定含有的离子是______________________________________________;
(2)①中生成的气体是______________(填化学符号),它具有的性质是_____________(填字母序号);
A.无色无味 B.能被NaOH溶液吸收 C.属于大气污染物 D.难溶于水
(3)①中发生反应的离子方程式有_______________________________________________。
(4)③中沉淀溶解的化学反应方程式是________________________________________。
【答案】Al3+、Fe2+、I-、NO![]() NO ACD 6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++ NO3-+4H+= 3Fe3++NO↑+2H2O Al(OH)3+NaOH=NaAlO2+2H2O
NO ACD 6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++ NO3-+4H+= 3Fe3++NO↑+2H2O Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
首先判断出哪些离子不能大量共存,Fe3+具有强氧化性,能将I-氧化,这两种离子不能大量共存,Fe3+、Al3+与CO32-发生双水解反应,不能大量共存,Fe3+与SO32-发生氧化还原反应不能大量共存,Fe2+与CO32-生成FeCO3沉淀,不能大量共存,然后根据实验现象分析溶液中含有的离子;
①加入过量的盐酸,产生气泡,溶液颜色加深,但溶液仍为澄清,说明原溶液中一定不含有SiO32-;
②向①反应后溶液中加入少量CCl4,出现分层,下层为CCl4层,显紫红色,推出该溶液中含有I2,即原溶液中含有I-,Fe3+具有强氧化性,能将I-氧化,因此原溶液中一定不含有Fe3+,NO3-在酸性条件下具有强氧化性,将I-氧化成I2,本身被还原成NO,因此原溶液一定含有NO3-,上层为水层,水层显黄色,推出含有Fe3+,即原溶液中含有Fe2+,原溶液中一定不含有CO32-;
③根据图像,推出原溶液中含有Al3+,溶液中一定不含有SO32-;
(1)根据上述分析,肯定含有的离子是Al3+、Fe2+、I-、NO3-;
答案为Al3+、Fe2+、I-、NO3-;
(2)①利用NO3-在酸性条件下具有强氧化性,将Fe2+、I-氧化,离子方程式为6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O,即①中产生的气体为NO,NO是一种无色、无味、难溶于水,有毒的气体,不能与NaOH发生反应,故选项ACD正确;
答案为ACD;
(3)根据问题(2)的分析,离子方程式为6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O;
答案为6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O;
(4)向溶液中加入NaOH溶液,发生Fe2++2OH-=Fe(OH)2↓、Al3++3OH-=Al(OH)3↓,氢氧化铝为两性,继续加入NaOH,发生Al(OH)3+OH-=AlO2-+2H2O;
答案为Al(OH)3+NaOH=NaAlO2+2H2O。


科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置可以用来发生、洗涤、干燥、收集 (不考虑尾气处理)气体。该装置可用于:
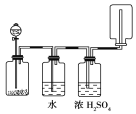
A.锌和盐酸生成氢气B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳D.KClO3和MnO2生成氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
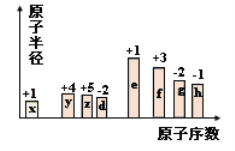
(1)f在元素周期表的位置是_______。
(2)上述元素形成的简单阴、阳离子中,离子半径最大的是(用化学式表示,下同)_______________;在e、f、g、h四种元素的最高价氧化物对应的水化物中的酸性最强的是___________________。
(3)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为________________,0.1 mol该化合物与足量水反应时转移的电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_________。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层) ![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
(7)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(8) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是

A. 四种毒品中都含有苯环,都属于芳香烃
B. 摇头丸经消去、加成反应可制取冰毒
C. 1 mol大麻与溴水反应最多消耗4 mol Br2
D. 氯胺酮分子中环上所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)氯气的制取方法有很多,写出实验室用MnO2来制取氯气的离子方程式__________。
(2)工业炼铁通常在___________设备中进行,需要用到铁矿石、焦炭、__________和空气。
(3)氯化铁溶液通常应用于印刷电路板制作,写出其反应的离子方程式___________。
(4)请写出红热的炭与浓硫酸反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇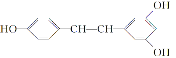 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
A. 白藜芦醇属于三元醇,能与Na反应产生H2
B. 能与NaOH反应,1 mol 该化合物最多能消耗NaOH 3 mol
C. 能使FeCl3溶液显色
D. 能与浓溴水反应,1 mol 该化合物最多能消耗溴6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com