
分析 (1)生成2molC的同时生成D为4L×0.25mol/L=1mol,物质的量之比等于化学计量数之比;
(2)由方程式可知,消耗的A为3mol,再根据v=$\frac{△c}{△t}$计算v(A);
(3)由方程式可知,消耗的B为1mol,B的转化率=$\frac{反应的B的物质的量}{B的起始物质的量}$×100%.
解答 解:(1)生成2molC的同时生成D为:4L×0.25mol/L=1mol,则2mol:1mol=2:x,所以x=1,
答:x的值为1;
(2)消耗的A为2mol×$\frac{3}{2}$=3mol,2分钟时用A表示的反应速率为:$\frac{\frac{3mol}{4L}}{2min}$=0.375mol/(L.min),
答:2分钟时用A表示的反应速率为0.375mol/(L.min);
(3)消耗的B为2mol×$\frac{1}{2}$=1mol,达到平衡时,B的转化率为:$\frac{1mol}{5mol}$×100%=20%,
答:达到平衡时,B的转化率为20%.
点评 本题考查化学平衡计算,比较基础,有利于基础知识的巩固.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:填空题

| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
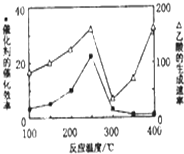 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com