
| A. | 该浓硝酸中HNO3的物质的量浓度是12.0 mol/L | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是20% | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL |
分析 A.根据c=$\frac{1000ρw}{M}$计算该浓硝酸的物质的量浓度;
B.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,根据n=$\frac{m}{M}$计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,根据电子转移守恒与二者质量之和列方程计算解答;
C.根据n=$\frac{V}{Vm}$计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,根据电子转移列方程计算;
D.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积.
解答 解:A.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故A错误;
B.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故B正确;
C.NO2和N2O4混合气体的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2的体积分数是$\frac{0.04mol}{0.05mol}$×100%=80%,N2O4的体积分数是20%,故C正确;
D.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故D错误;
故选AD.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒及原子守恒为解答的关键,侧重分析与计算能力的考查,注意物质的量的相关计算公式,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| B. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
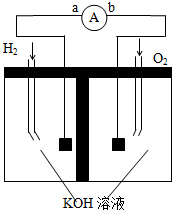 氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题
氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 酸性氧化物 | 碱性氧化物 | 酸 | 盐 |
| A | 碱石灰 | 二氧化硫 | 氧化铝 | 乙二酸 | 小苏打 |
| B | 五水硫酸铜 | 三氧化硫 | 氧化铜 | 油酸 | 苏打 |
| C | 过氧化氢 | 五氧化二磷 | 过氧化物 | 硬脂酸 | 碱式碳酸铜 |
| D | 盐酸 | 一氧化碳 | 氧化镁 | 冰醋酸 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | CH≡CH$→_{催化剂△}^{HCl}$CH2=CHCl$→_{△}^{催化剂}$ | |
| C. | HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{NaOH}^{CH_{2}OH}$HCOOCH3 | |
| D. | CH2═CH2$→_{催化剂△}^{O_{2}}$CH3CHO$→_{△}^{银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
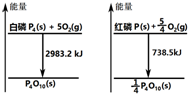
| A. | 白磷比红磷稳定 | |
| B. | 白磷燃烧产物比红磷燃烧产物稳定 | |
| C. | 1mol白磷转变为红磷放出2244.7kJ的热量 | |
| D. | 红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com