
【题目】叠氮酸钠(NaN3)是汽车安全气囊的产气剂,Fe2O3是主氧化剂,NaHCO3作冷却剂。当汽车发生剧烈碰撞时,分解产生大量气体使安全气囊迅速打开,从而起到安全保护作用[已知Ka(HN3)=1.8×10-5]。下列有关说法正确的是
A. NaHCO3的冷却原理是它发生分解,消耗体系的热量
B. Fe2O3和Na反应的氧化产物是Na2O2
C. 等物质的量的NaN3和HN3混合溶液显碱性
D. 若有6.5 gNaN3分解产生N2,则转移0.9 mol电子
【答案】A
【解析】
A.NaHCO3分解产生碳酸钠、水和二氧化碳,分解吸收热量,从而使环境温度降低,因而它可以起到冷却作用,A正确;
B.Fe2O3和Na反应产生FeO和Na2O,所以氧化产物是Na2O,B错误;
C.根据Ka(HN3)=1.8×10-5可知HN3是弱酸,NaN3的水解平衡常数Kh=![]() <1.8×10-5,说明等物质的量的NaN3和HN3混合,酸的电离作用大于盐的水解作用,所以溶液显酸性,C错误;
<1.8×10-5,说明等物质的量的NaN3和HN3混合,酸的电离作用大于盐的水解作用,所以溶液显酸性,C错误;
D. NaN3受到撞击,发生分解反应,产生N2和金属Na,反应方程式为2NaN3![]() 3N2+2Na,根据反应方程式可知:每有2mol NaN3反应,产生3molN2,反应转移2mol电子,则6.5g NaN3反应,即有0.1mol该物质反应,转移的电子的物质的量为0.1mol,D错误;
3N2+2Na,根据反应方程式可知:每有2mol NaN3反应,产生3molN2,反应转移2mol电子,则6.5g NaN3反应,即有0.1mol该物质反应,转移的电子的物质的量为0.1mol,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】已知t℃时AgCl的Ksp=2×10-10;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
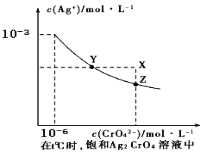
A. 在t℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研发的锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如图。下列有关该电池的说法正确的是
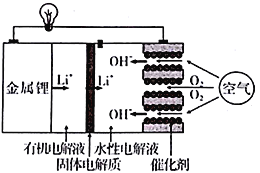
A. 有机电解液可以换成水性电解液
B. 放电时,外电路通过2 mol 电子,消耗氧气11.2 L
C. 放电和充电时,Li+迁移方向相同
D. 电池充电时,在正极上发生的反应为4OH--4e-= O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为______写化学式),0~t1 时间段的温度为_____,0~t1 时间段用SO2 表示的化学反应速率为_____。
②总反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
(1)常温下,在 pH = 5 的稀醋酸溶液中,c(CH3COO-)=_____(不必化简)。下列方法中,可以使 0.10 mol·L-1 CH3COOH 的电离程度增大的是_____
a.加入少量 0.10 mol·L-1 的稀盐酸 b.加热 CH3COOH 溶液
c.加水稀释至 0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量 0.10 mol·L-1 的 NaOH 溶液
(2)将等质量的锌投入等体积且 pH 均等于 3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_____V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。(填写“>”、“<”或“=”)
(3)已知:90℃时,水的离子积常数为 Kw=3.8×10-13,在此温度下,将 pH=3 的盐酸和 pH=11 的氢氧化钠溶液等体积混合,则混合溶液中的 c(H+)=_____mol/L(保留三位有效数字)。
Ⅱ.(1)常温下,已知 0.1 mol·L-1 一元酸HA 溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1mol·L-1 HA溶液的 pH=_____;
(2)常温下,向 pH=a 的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的 pH_____(14-a)(填写“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用的电池是一个液体电解质将两个固体电极隔开。而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过。下列有关说法不正确的是

A. a为电池的正极
B. 充电时b接电源的正极
C. 正极反应为:nS8+16ne-=8Sn2-
D. Na+可以穿过固体电解质从而传递电流
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com