
��16�֣�ij�о����Ժ���������������ͭ�Ĺ�ҵ���Ͻ�����ص��о���ʵ��������£�

�ش��������⣺
��1�������ijɷ�Ϊ____��____��(�ѧʽ) �����ٵ�����Ϊ____ ��
��2����ͼ��ҺB����������Ӧ�����ӷ���ʽΪ __________  ��
��
��3��ʵ��Ҫ������ҺB��ͨ������Ŀ�����֤��ͨ����������ķ����� ��
��4�������۵�һ����Ҫ���������˾ƾ��ơ�����̨�⣬����Ҫ___ _��___ _ ��
��5��ijͬѧ��������װ���Ʊ�����������������ԭij�������������Ҫ��ش����⡣

�����һ��ʵ�鷽����֤H2�Ļ�ԭ�� �����������������װ������˳����A��_____��_____��_____��D����Dװ���⣬����װ�ò����ظ�ʹ�ã������Dװ��������ҩƷΪ________ ___����������
�����������������װ������˳����A��_____��_____��_____��D����Dװ���⣬����װ�ò����ظ�ʹ�ã������Dװ��������ҩƷΪ________ ___���������� ___________��
___________��
��16�֣�ÿ��2�֣�
��1��Fe��Cu������1�֣�����
��2��4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3��
��3��ȡ�ϲ���Һ�������Թ��У��������Ը��������Һ�����Ը��������Һ����ɫ���䡣��2�֣���
��4����������������1�֣�
��5��A��C��B��D��D��2�֣�����ʯ�ң�2�֣���
��ֹ������ˮ��������ǰ��װ���У�2�֣�
��������
�����������1����������ͼ��֪����Ļ�ԭ����Fe������ͭ��Ӧ��������������Cu�����������ijɷ���Fe��Cu������Һ�벻�ܵĹ������IJ����ǹ��ˣ����Բ����ٵ�����Ϊ���ˣ�
��2��ͨ�����Ŀ���ǰ�������������Ϊ�����ӣ���ͨ�백����������������������������ܵ����ӷ���ʽ��4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3����
��3������������������ҺB�в������������ӣ�����֤��������������֤����ҺB�����������Ӽ��ɡ�ȡ��ҺB���ϲ���Һ�������Թ��У��������Ը��������Һ�����Ը��������Һ����ɫ���䣬֤������������
��4���������Ǵ���Һ�еõ����壬���Ե�һ��������Ũ������Ҫ���������˾ƾ��ơ�����̨�⣬����Ҫ������������
��5��Aװ���Dz���������װ�ã�����������Ӧ�������ͨ��B�У�������Ũ����������������������ˮ������ˮ����ͭ�������ˮ�����ɣ���������ͨ��D�У�D��ʢ����ˮ����ͭ���壬�������ͨ�������D��ȼ������װ�õ�����˳����A��C��B��D��D�����D�е�ҩƷ�Ǽ�ʯ�ң�Ŀ���Ƿ�ֹ������ˮ��������ǰ��װ���У�Ӱ��������������ļ��顣
���㣺���������ͼ�ķ�����ʵ�鷽������������ۣ������������жϣ����ӵļ���


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��������ԭ��Ӧ�ı����ǵ��ӵ�ת��
B�����Ϸ�Ӧһ����������ԭ��Ӧ
C��������ijԪ��ʧȥ���ӣ����������������
D�����ӷ�Ӧ�����Ǹ��ֽⷴӦ����һ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
��ʳ���������ؽ���(Cu2+ )��ʳ���ʹ���ж����ɷ��������������ʻ����ж��̶�
A���������� Bʳ��ˮ C����ˮ D���״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�٢ڢۢ����ֽ���Ƭ������������ϡ�����ж������ԭ��أ��٢�����ʱ�����·�����Ӣ�����٣��٢�����ʱ����Ϊ�������ڢ�����ʱ�������������ݳ����ۢ�����ʱ���۵��������٣��ݴ��ж������ֽ��������ǿ������˳����
A���٢ۢڢ� B���٢ۢܢ� C���ۢܢڢ� D���ۢ٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�ã���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd��OH��2+2Ni��OH��2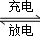 Cd+2NiO��OH��+2H2O���йظõ�ص�˵����ȷ����
Cd+2NiO��OH��+2H2O���йظõ�ص�˵����ȷ����
A���ŵ�ʱ������Ӧ��NiO��OH��+e��+H2O�TNi��OH��2+OH��
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ijǿ������Һ�п��ܴ���NO3����I����Cl����Fe3+�е�һ�ֻ��֡������Һ������ˮ���屻��ԭ���ɴ��ƶϸ���Һ��
A������NO3����Ҳ����Fe3+ B������NO3����I����Cl��
C����I��������Cl�� D������Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ����������Ӧ���۾���ȷ����
ѡ�� | ���� | ���� | ���� |
A | ��Ũ����ε����DZ��� | ���������� | Ũ��������ˮ�Ժ�ǿ������ |
B | �����½�AlƬ����Ũ������ | �����Ա仯 | Al��Ũ�����Ӧ |
C | ��������ͨ��Ʒ����Һ�� | Ʒ����Һ��ɫ | ����������л�ԭ�� |
D | ��ˮ����ͨ�����ȵ����� | ��ĩ��� | ����ˮ�ڸ����·�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ������¿������Ծ��������棩 ���ͣ������
��14�֣�����Ӧ����㷺�Ľ���������±���������Ⱦ�Ϊ��Ҫ������ش��������⡣
��1��FeCl3��Һ���������������е�SO2���÷�Ӧ�����ӷ���ʽ��________________��
��2����֪��Ӧ��3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3����1L 0.4mol/L��FeBr2��Һ��ͨ��6.72LCl2����״������д���÷�Ӧ�����ӷ���ʽ�����ܷ���ʽ��ʾ��______________________
��3����֪����ij�������ﻯѧʽΪFexO��x<1������Ԫ�ص���������Ϊ76.3%����FexO��xֵ(��ȷ��0.01)Ϊ ______�����������е�Fe�ֱ�ΪFe2+��Fe3+������n(Fe2+):n(Fe3+)= _________
��4����һ����������������ϡH2SO4��������CuO�Ƶ���ͭ����������������ַ�����
��Fe  H2
H2  Cu����CuO
Cu����CuO  CuSO4
CuSO4  Cu��
Cu��
��ʵ������У����ݹ淶��ʵ�鷽����ʵ�����������в������������Ƶõ���ͭ�������Ƚ���ȷ����__________
A����� B���ٶ� C���ڶ� D�����ж�
��5��������ͭ�Ļ�����У����벻������ϡ���ᣬ��Ӧ��ʣ�����m1 g���������м���һ����ϡ���ᣬ�����ʣ�����m2 g����m1________������ڡ��������ܴ��ڡ��������ڡ����ܵ��ڡ���m2
��6������Ϊ������ͭΪ��������������NaOH��Һ���е�⡣һ��ʱ���õ�4molFe(OH)3�������˼乲���ĵ�ˮ�����ʵ���Ϊ_______mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����и���һ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ҵ�������о�����CO2�������״�ȼ�ϣ��÷����Ļ�ѧ����ʽΪCO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H=��49.0kJ/mol��һ���¶��£��������ݻ���Ϊ3.0L�ĺ����ܱ������з����÷�Ӧ��
CH3OH(g)+H2O(g) ?H=��49.0kJ/mol��һ���¶��£��������ݻ���Ϊ3.0L�ĺ����ܱ������з����÷�Ӧ��
���� | ��ʼ���ʵ�����mol | ƽ�����ʵ�����mol | |||
��� | �¶ȣ��� | CO2(g) | H2(g) | CH3OH(g) | H2O(g) |
�� | T1 | 3 | 4 | 0.5 | 0.5 |
�� | T1 | 1.5 | 2 | ||
�� | T2 | 3 | 4 | 0.8 | 0.8 |
�����й�˵������ȷ����
A��������2min����I�з�Ӧ��ƽ�⣬��2min��ƽ������V(H2)=0.25 mol��(L��min)
B���ﵽƽ��ʱ������I��CO2ת���ʵı�������Ĵ�
C���ﵽƽ��ʱ���������з�Ӧ�ų����������������2����
D�����������ж�Ӧ�����µ�ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1=K2<K3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com