
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |
分析 A.非金属性越强,对应氢化物的稳定性越强;
B.金属的金属性越强,其对应碱的碱性越强;
C.非金属的非金属性越强,其最高价含氧酸的酸性越强;
D.非金属的非金属性越强,对应阴离子的还原性越弱.
解答 解:A.非金属性O>Cl>S,非金属性越强,氢化物稳定性越强,则氢化物稳定性:H2O>HCl>H2S,故A错误;
B.同一主族中,元素的金属性随着原子序数的增大而增大,所以金属性K>Na,金属的金属性越强,其对应碱的碱性越强,所以碱性强弱:KOH>NaOH,故B错误;
C.同一主族中,元素的非金属性随着原子序数的增大而减小,所以非金属性Cl>Br>I,非金属的非金属性越强,其最高价含氧酸的酸性越强,所以酸性:HClO4>HBrO4>HIO4,故C正确;
D.已知非金属性Cl>Br>I,元素的非金属性越强,则对应的阴离子的还原性越弱,离子的还原性:I->Br->Cl-,故D错误.
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,试题侧重基础知识的考查,有利于培养学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: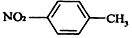 | |
| C. | CSO的电子式: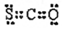 | |
| D. | F-的离子结构示意图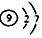 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH溶液 | B. | 加入少量的NaHSO4溶液 | ||
| C. | 加入少量的CH3COONa溶液 | D. | 加入少量的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知二元酸H2A在溶液中的电离方程式为:H2A═H++HA- HA-?H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)═c(A2-)+c(HA-)+c(H2A)和c(A2-)═c(H+)-c(OH-) | |
| B. | 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10 | |
| C. | HCN溶液加水稀释的过程中$\frac{c({H}^{+})}{c(C{N}^{-})}$减小 | |
| D. | 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
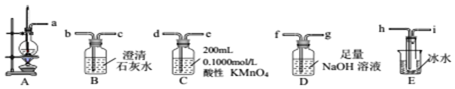
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com