
| A. | 明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 | |
| C. | Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 | |
| D. | 水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
科目:高中化学 来源: 题型:选择题
| A. | 甘油(CH2OH-CHOH-CH2OH)分子中含有1个手性碳原子 | |
| B. | 互为手性异构体的化合物,所含化学键的种类和数目完全相同 | |
| C. | 互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同 | |
| D. | 互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质都能与盐酸反应放出氢气 | |
| D. | 单质的熔、沸点随着原子序数的增加而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M一定是金属元素 | B. | M一定是S区元素 | C. | M的最高价是+1价 | D. | M可能呈现出-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | Li | Be | B | C | N | O | F |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
| 第三周期 | Na | Mg | Al | Si | P | S | Cl |
| 电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
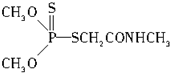
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
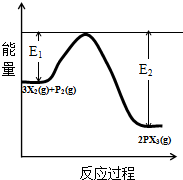
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
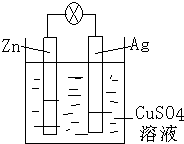 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
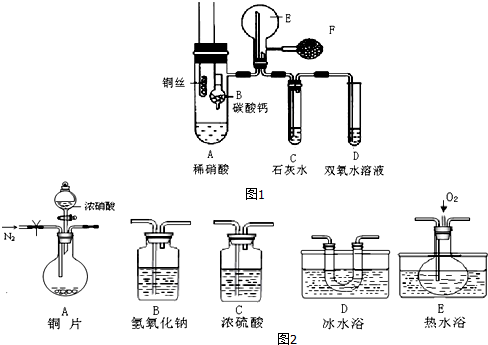
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com