
【题目】1mol甲烷和氯气发生取代反应,待反应完成后,测得四种取代物的物质的量相等,则消耗氯气的物质的量为
A.0.5molB.2molC.2.5molD.4mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
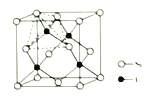
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单烯烃A(C8H16)可以发如下图所示的转化,回等下列问题:
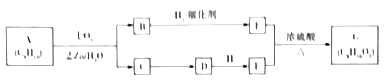
已知:a. 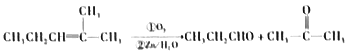
b.B的核磁共振氢谱图中有2个峰,峰面积之比是2:3.
(1)B的分子式为______;E的名称为______,1molE最多加与_____molNa2CO3反应.
(2)写出C![]() D、E+F
D、E+F![]() G反应的化学方程式:___________。
G反应的化学方程式:___________。
(3)A能形成高分子(C8H16)n,平均1molA中含有的甲基数是____(用NA表示阿伏加德罗常数的值)。
(4)B不能发生银镜反应,其同分异构体X能发生银镜反应,X的结构有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实
①由X电极、碳棒和Y的硫酸盐溶液形成的原电池,碳棒上生成一层Y金属
②Z+H2O(冷)===Z(OH)2+H2↑
③由Y和W电极组成的电池,Y电极反应为Y-e-===Y2+
可知X、Y、Z、W的金属活泼性顺序为
A.X>Z>Y>WB.Z>W>X>Y
C.Z>Y>X>WD.Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________;X、Y形成的含18电子的化合物的电子式____________;
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________;
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
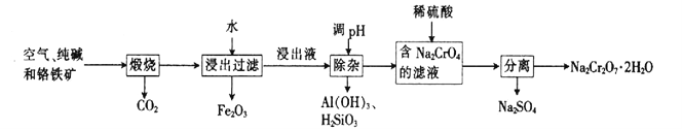
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
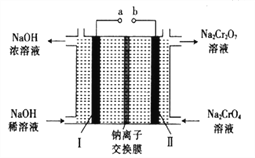
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,是一种常见的有机溶剂。s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是( )
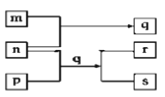
A. q的水溶液呈黄色 B. W的氧化物常温常压下为液态
C. p能使酸性高锰酸钾溶液褪色 D. Z的氧化物的水化物可能为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
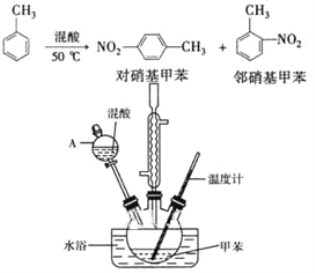
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_______________________。反应中需不断搅拌,目的是__________________________________________。
(2)仪器A的名称是______,使用该仪器前必须进行的操作是____。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_____。
(4)分离反应后产物的方案如下:

其中,操作1的名称为______,操作2中需要使用下列仪器中的____(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为______(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com