
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
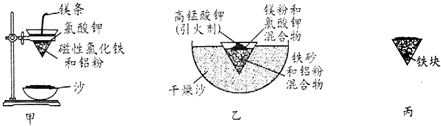
分析 (1)考虑生成的熔融的铁的还原性,可以被空气中的氧气氧化导致生成三价的铁;
(2)根据铝与铁的性质的差异性来选择试剂,并写出反应;
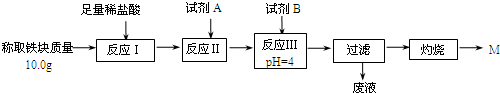
(3)①根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀.
②根据Fe(OH)3的Ksp的表达式来进行计算;
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g;
④根据10.0g的铁块中的铁元素最终全到了最终红色粉未M中,根据铁原子的守恒来计算;如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,此时应考虑Fe(OH)3的分解,引起计算结果偏小.
解答 解:(1)铝热反应生成的熔融的铁具有很强的还原性,可以被空气中的氧气氧化导致生成三价的铁,
故答案为:熔融的铁被空气中氧气氧化;
(2)要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:氢氧化钠溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大;也不能用MgCO3固体,因为MgCO3固体过量时会引起所得固体M则质量偏大,故应选用氨水,故答案为:C;D;
②根据Fe(OH)3的Ksp=C(Fe3+)•C3(OH-)=1.1×10-36,而pH=4,故C(OH-)=10-10mol/L,带入Ksp=C(Fe3+)•C3(OH-)=1.1×10-36,计算得C(Fe3+)=1.1×10-6mol/L,
故答案为:1.1×10-6;
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g,故答案为:前后两次灼烧质量相差不大于0.1g;
④最终红色粉未M为Fe2O3,根据10.0g的铁块中的铁元素最终全到了12.0gFe2O3中,故铁原子的质量为:m(Fe)=$\frac{12.0g}{160g/mol}$×2×56gmol=8.4g
故该“铁块”的纯度=$\frac{8.4g}{10.0g}$×100%=84%;如果对所得过滤固体直接洗涤、烘干、称量,烘干过程中会引起Fe(OH)3的分解,故会导致计算结果偏小.
故答案为:84%;偏小;Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
点评 本题综合考查了铝热反应以及亚铁离子向三价铁离子的转化以及离子的沉淀,综合性较强,难度较大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应③中Br2 是氧化剂,溴元素被氧化 | |
| B. | 氧化性强弱顺序为:MnO4->Cl2>Fe3+>Br2 | |
| C. | 反应①中,被氧化的HCl占参加反应的HCl的5/8 | |
| D. | 溶液中可发生反应:2Fe3++2Cl-=2Fe2++Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂可以加快合成氨的速率 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 白铁(镀锌铁)镀层破损后,铁皮依然受到保护 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. |  分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. |  比较Na2CO3和NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,该反应达到平衡状态时,生成CO2为0.4 mol | |
| D. | 若平衡浓度符合关系式$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1 000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入足量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+OH-=SiO32-+H2O | |
| D. | 氧化铝与NaOH溶液反应:Al2O3+10OH-=2[Al(OH)4]-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 常温常压下,16克氧气含原子数为2NA | |
| C. | 0.1 mol•L-1的 FeCl3溶液Cl-的数目为0.3NA | |
| D. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com