
分析 (1)Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,利用电子守恒计算;
(2)反应中Fe的化合价从+2价到+3价,N元素的化合价从+5价降低到+3;根据化合价升降总数相等和质量守恒来配平方程式;双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目;
(3)氧化还原反应中还原剂失电子发生氧化反应生成的产物为氧化产物;
(4)根据NxOy与电子之间的关系计算.
解答 解:n(FeSO4)=$\frac{7.6g}{152g/mol}$=0.05mol,n(KNO3)=0.05L×0.5mol/L=0.025mol,
Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,
由电子守恒可知,Fe失去电子等于N得到电子,设N被还原后元素化合价为m,则
0.05mol×(3-2)=0.025mol×(5-m),
解得m=+3,只有N2O3中N元素的化合价为+3价,则x=2,y=3;
故答案为:2;3;
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+3价,变化2,化合价升降总数相等和质量守恒来配平方程式为:
4FeSO4+2KNO3+3H2SO4=K2SO4+2Fe2(SO4)3+N2O3↑+3H2O,用单线桥法标出电子转移为 ;
;
故答案为:4;2;3;1;2;1;3; ;
;
(3)氧化还原反应中还原剂失电子发生氧化反应生成的产物为氧化产物,所以反应中氧化产物是Fe2(SO4)3;
故答案为:Fe2(SO4)3;
(4)标准状况下,当生成N2O3气体的体积为2.24L时,即0.1mol转移电子为0.1mol×2×(5-3)=0.4mol,即0.4NA个,
故答案为:0.4NA.
点评 本题主要考查了氧化还原反应的计算、氧化还原反应的配平、氧化产物的判断及分析氧化还原反应用,题目难度中等,注意基础知识的掌握,明确元素的化合价变化来分析是解答本题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
某有机物的结构为如图所示,这种有机物不可能具有的性质是( )| A. | ①④ | B. | 只有⑤ | C. | ②⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -916.9 kJ/mol | B. | -458.45 kJ/mol | C. | +916.9 kJ/mol | D. | +458.45 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 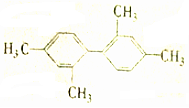 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物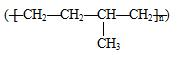 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com