
【题目】Ⅰ、根据氧化还原反应:2Ag+(aq)+ Cu(s) = Cu2+(aq)+ 2Ag(s) 设计的原电池如下图所示,其中盐桥为琼脂–饱和KNO3盐桥。请回答下列问题:
(1)电极X的材料是 ___________;电解质溶液Y是 ____________________。
(2)银电极为电池的 __________ 极,其电极反应式为:___________________________________ 。
(3)盐桥中向CuSO4溶液中迁移的离子是 ___________。

A、K+ B、NO3― C、Ag+ D、SO42―
Ⅱ、酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料。回答下列问题:
(1)该电池的正极反应式为 ________________________,电池反应的离子方程式为________________________________________
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 ___________________________________ 分离回收。
(3)滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是_________________________________________。
【答案】Cu AgNO3溶液 正极 2Ag++2e-=2Ag B MnO2+H++e-=MnOOH 2MnO2+Zn+2H+=2MnOOH+Zn2+ 加热浓缩;冷却结晶 在足量的空气或氧气中加热
【解析】
Ⅰ、由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极。盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极),以此解答;
Ⅱ、(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液;
(3)在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰。
Ⅰ、(1)硫酸铜溶液所在的电极是负极,所以电极X的材料是Cu;银电极是正极,则电解质溶液Y是AgNO3溶液;
(2)银离子得到电子,银电极为电池的正极,发生的电极反应式为2Ag++2e-=2Ag;
(3)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4溶液中迁移的离子应是阴离子,应为NO3-;
故答案为:B;
Ⅱ、(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液,到一定程度NH4Cl析出,而ZnCl2保留在水中,达到分离的目的;
答案为:加热浓缩;冷却结晶;
(3)填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰;
答案为:在足量的空气或氧气中加热。


科目:高中化学 来源: 题型:
【题目】常温下,向1 L浓度为0.4 mol·L-1的乙醇酸[CH2(OH)COOH]溶液中加入8 g NaOH固体得到X溶液,将X溶液平均分成两等份,一份通入HCl气体,得到溶液Y,另一份加入NaOH固体得到溶液Z,溶液Y、Z的pH随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。下列说法正确的是

A. c点对应曲线代表的是加入NaOH的曲线
B. 溶液中水的电离程度:c>b
C. a点:c[CH2(OH)COO-]>c(Na+)>c(H+)>c(OH-)
D. 稀释Y溶液后,溶液中![]() 变大
变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素的单质及其化合物在生活、生产中有广泛应用。
(1)下列电子排布图能表示基态N原子的电子排布情况的是________![]() 填代号
填代号![]() 。
。
A. 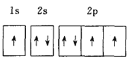 B.
B. 
C. 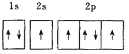 D.
D. 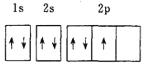
(2)键角:![]() ,从原子结构角度分析原因:__________________。
,从原子结构角度分析原因:__________________。![]() 中As原子的杂化类型是_____________,空间构型是_______________。
中As原子的杂化类型是_____________,空间构型是_______________。
(3)白磷中毒后,用硫酸铜溶液解毒,其化学反应原理如下:![]()
![]() 白磷的结构如图所示,上述反应转移
白磷的结构如图所示,上述反应转移![]() 电子时,破坏
电子时,破坏![]() ______
______![]() 键。与
键。与![]() 中阴离子互为等电子体的分子有______
中阴离子互为等电子体的分子有______![]() 填一种即可
填一种即可![]() 。
。

![]() 中铜离子的价层电子排布式为_____________________。
中铜离子的价层电子排布式为_____________________。
![]() 在
在![]() 溶液中滴加过量氨水生成蓝色溶液,主要成分是
溶液中滴加过量氨水生成蓝色溶液,主要成分是![]() ,它不含的作用力类型有_______。
,它不含的作用力类型有_______。![]() 填代号
填代号![]()
![]() 离子键
离子键 ![]() 金属键
金属键 ![]() 配位键
配位键 ![]() 极性共价键
极性共价键
(4)联氨![]() 的沸点为
的沸点为![]() ,联磷
,联磷![]() 的沸点为
的沸点为![]() ,其主要原因是_____________。
,其主要原因是_____________。
(5)磷化硼是半导体材料,早在1891年,法国化学家亨利![]() 莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为______________。磷化硼的熔点为
莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为______________。磷化硼的熔点为![]() ,它的晶体类型是______________。
,它的晶体类型是______________。
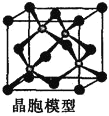
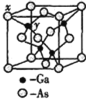
(6)砷化镓是重要的半导体材料,用来制作半导体激光器和太阳电池等元件。砷化镓晶胞如图所示。已知砷化镓的摩尔质量为![]() ,密度为
,密度为![]() ,
,![]() 代表阿伏加德罗常数的值。图中x和y最短核间距离为____________________pm。
代表阿伏加德罗常数的值。图中x和y最短核间距离为____________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
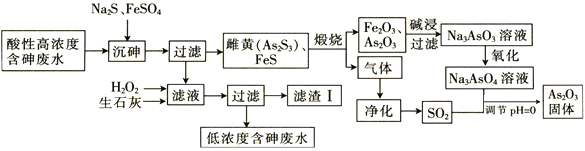
【题目】![]() 在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水
在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水![]() 主要以
主要以![]() 形式存在
形式存在![]() 提取
提取![]() 的工艺流程如下:
的工艺流程如下:
回答下列问题:
![]() 上述流程的__________过程中由于条件的原因,造成生成物中混有
上述流程的__________过程中由于条件的原因,造成生成物中混有![]() ,为证明
,为证明![]() 的存在,可利用
的存在,可利用![]() 具有____________性的这一物理性质。
具有____________性的这一物理性质。
![]() 调节
调节![]() 时,由
时,由![]() 制备
制备![]() 的离子方程式为_____________________________。
的离子方程式为_____________________________。
![]() 常温下,用NaOH溶液滴定
常温下,用NaOH溶液滴定![]() 时,各种微粒的物质的量分数随pH的变化曲线如图所示:
时,各种微粒的物质的量分数随pH的变化曲线如图所示:
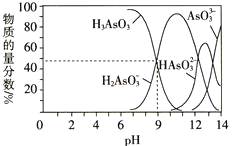
![]() AsO
AsO![]() 为________元________
为________元________![]() 填“强”或“弱”
填“强”或“弱”![]() 酸。
酸。
![]() 由7调节至10的过程中发生反应的离子方程式为____________________________。
由7调节至10的过程中发生反应的离子方程式为____________________________。 ![]() 的一级电离平衡常数
的一级电离平衡常数![]() _______。
_______。
![]() 滤渣Ⅰ中含有
滤渣Ⅰ中含有![]() 、
、![]() 、
、![]() 和_______________
和_______________![]() 填化学式
填化学式![]() ;已知
;已知
![]() ,含砷污染物允许排放标准为不大于
,含砷污染物允许排放标准为不大于![]() 。若低浓度含砷废水
。若低浓度含砷废水![]() 假设砷均以
假设砷均以![]() 形式存在
形式存在![]() 中
中![]() 的浓度为
的浓度为![]() ,则低浓度含砷废水中
,则低浓度含砷废水中![]() 的浓度为_________
的浓度为_________![]() ,________
,________![]() 填“符合”或“不符合”
填“符合”或“不符合”![]() 排放标准。
排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
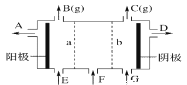
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-= 2H2O+O2↑
D.Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是

A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
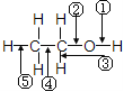
A. 和金属钠作用时,键①断裂
B. 和浓H2SO4共热至170℃时,键②和⑤断裂
C. 和浓H2SO4共热至140℃时,键③⑤断裂
D. 在Ag催化剂下和O2反应时,键①和③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
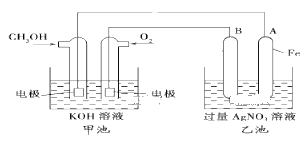
(1)充电时,原电池的负极与电源___极相连。乙池中阳极的电极反应为___。
(2)放电时:负极的电极反应式为___。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2___L(标准状况下)。
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是___
A.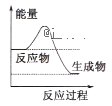 B.
B. C.
C.
(2)人们普遍使用的干电池工作时是将化学能转化为___。
(3)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
(4)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

①电极X的材料是___;电解质溶液Y是___;
②银电极为电池的___极,发生的电极反应为___;X电极上发生的电极反应为___;
③如果闭合电路前X电极与银电极质量相等,当电路中通过0.1mol电子时,两电极质量差为___g。(原子量Cu:64;Ag:108)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com