
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |

分析 (1)由盖斯定律可得,总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3;
化学平衡常数K=K12•K2•K3;
(2)要提高CH3OCH3产率,应该改变条件使平衡正向移动;
(3)新工艺中反应③消耗反应②中的产物H2O,减小生成物的浓度,有利于平衡向正反应方向移动;
(3)勒夏特列原理:如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动;
(4)A.升高温度CO转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动;
B.增大压强平衡正向移动,则CO转化率增大,根据图知,压强P1>P2>P3,增大压强CO转化率增大;
C.当反应物的物质的量之比等于其计量数之比时,反应物的转化率相等;
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率增大;
(5)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数,相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),
开始(mol)8.0 4.0 0 0
反应(mol)2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数=$\frac{0.5x}{8.0-2x+4.0-x+0.5x+0.5x}$×100%=25%,
x=3
则平衡时c(H2)=$\frac{8.0-6.0}{2}$=1mol/L、c(CO)=$\frac{4-3}{2}$=0.5mol/L、c(CH3OCH3)=$\frac{1.5}{2}$mol/L=0.75mol/L、c(H2O)=$\frac{1.5}{2}$mol/L=0.75mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{4}({H}_{2}){c}^{2}(CO)}$.
解答 解:(1)由盖斯定律可得,总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ•mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12•K2•K3.
故答案为:-263 kJ•mol-1;K12•K2•K3;
(2)A.分离出二甲醚,使平衡正向移动,所以能提高二甲醚的产率,故正确;
B.升高温度,平衡逆向移动,降低二甲醚的产率,故错误;
C.改用高效催化剂只能改变化学反应速率,不影响平衡移动,不改变二甲醚产率,故错误;
D.增大压强平衡正向移动,提高二甲醚产率,故正确;
故答案为:AD;
(3)(4)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)A.升高温度CO转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,则该反应△H<0,故A错误;
B.增大压强平衡正向移动,则CO转化率增大,根据图知,压强P1>P2>P3,增大压强CO转化率增大,CO转化率应该大于50%,故B错误;
C.当反应物的物质的量之比等于其计量数之比时,反应物的转化率相等,所以若在p3和316℃时反应达到平衡,H2的转化率等于50%,故C正确;
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率增大,所以CO转化率大于50%,故D正确;
故答案为:CD;
(5)相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),
开始(mol)8.0 4.0 0 0
反应(mol)2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数=$\frac{0.5x}{8.0-2x+4.0-x+0.5x+0.5x}$×100%=25%,
x=3
则平衡时c(H2)=$\frac{8.0-6.0}{2}$=1mol/L、c(CO)=$\frac{4-3}{2}$=0.5mol/L、c(CH3OCH3)=$\frac{1.5}{2}$mol/L=0.75mol/L、c(H2O)=$\frac{1.5}{2}$mol/L=0.75mol/L,化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{4}({H}_{2}){c}^{2}(CO)}$=$\frac{0.75×0.75}{0.{5}^{2}×{1}^{4}}$=2.25,
故答案为:2.25.
点评 本题考查化学平衡计算、盖斯定律、化学平衡移动影响因素等知识点,侧重考查学生分析、判断及计算能力,明确温度、压强对化学平衡移动影响及三段式方法在化学平衡计算中的灵活应用是解本题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
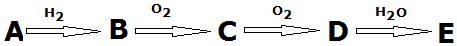
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
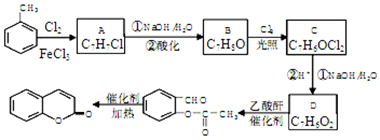
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应.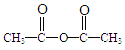 )反应,除生成
)反应,除生成 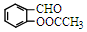 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH.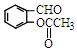 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
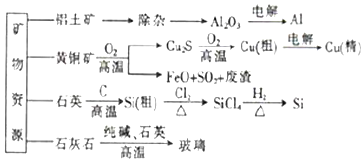
| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用过滤的方法(SiCl4的熔点-70℃,沸点57.7℃) | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在反应中被还原 | |
| B. | NaClO3在反应中失去电子 | |
| C. | H2SO4在反应中作氧化剂 | |
| D. | 1 mol氧化剂在反应中得到1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在KClO3+6HCl=3Cl2↑+KCl+3H2O中,被氧化的氯原子和被还原的氯原子的个数比为6:1 | |
| B. | 在反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,则被还原的元素为氮和硫 | |
| C. | 失电子能力难的原子获得电子的能力一定强 | |
| D. | 在化学反应中某元素由化合态变为游离态,该元素一定被还原了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com