
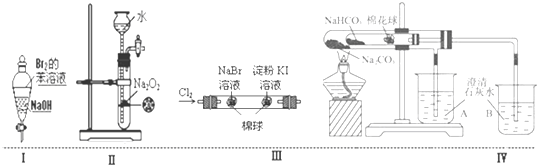
| A、实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B、实验Ⅱ:可随关随停,随开随启控制氧气的发生 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性Cl2>Br2>I2 |
| D、实验Ⅳ:小试管中NaHCO3分解,B中石灰水变浑浊,说明稳定性Na2CO3>NaHCO3 |


科目:高中化学 来源: 题型:
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
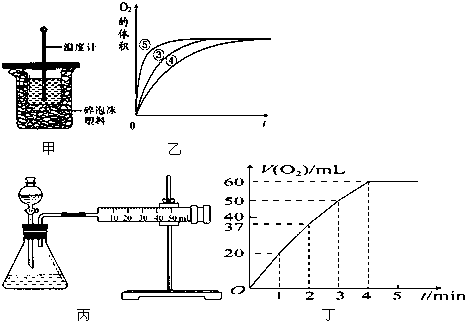 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请按下列要求填空
请按下列要求填空查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ |
| B、①②⑥⑦ |
| C、①③④⑤⑦ |
| D、全部都不能带上车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
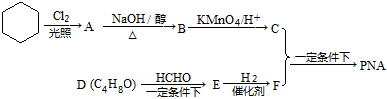
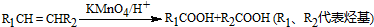
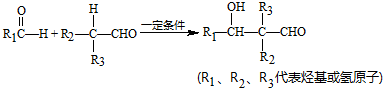
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、K+、SO42-、Cl-、AlO2- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com