
【题目】下列属于电解质的是( )
A.铝B.酒精C.食盐水D.硫酸铜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:
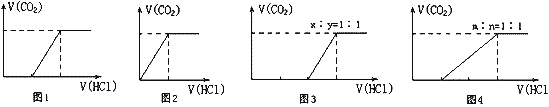
(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
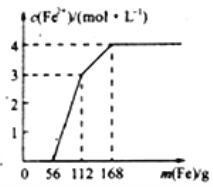
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
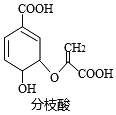
A. 分子中含有2种官能团
B. 1mol分枝酸最多可与3molNaOH发生中和反应
C. 可与乙醇、乙酸反应,且反应类型相同
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g)+2NO(g)![]() 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
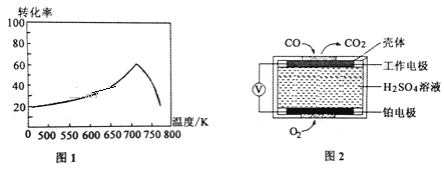
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答相关的问题。
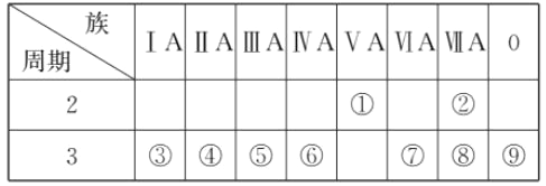
(1)写出④的元素符号________。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:___________________________。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是________(填相应化学式,下同),碱性最强的是________。
(4)这些元素中(除⑨外),原子半径最小的是________(填元素符号,下同),原子半径最大的是________。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示) _____________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com