
分析 设平衡时转化的二氧化硫为xmol,则:
2 SO2(g)+O2(g)?2 SO3(g)
起始量(mol):0.3 0.2 0
变化量(mol):x 0.5x x
平衡量(mol):0.3-x 0.2-0.5x x
根据压强之比等于物质的量之比,则0.3-x+0.2-0.5x+x=90%×(0.3+0.2),进而计算二氧化硫转化率.
解答 解:设平衡时转化的二氧化硫为xmol,则:
2 SO2(g)+O2(g)?2 SO3(g)
起始量(mol):0.3 0.2 0
变化量(mol):x 0.5x x
平衡量(mol):0.3-x 0.2-0.5x x
压强之比等于物质的量之比,则0.3-x+0.2-0.5x+x=90%×(0.3+0.2),解得x=0.1,则二氧化硫转化率为$\frac{0.1mol}{0.3mol}$×100%=33.3%,
故答案为:33.3%
点评 本题考查化学平衡计算,比较基础,注意三段式均摊法应用,有利于基础知识的巩固.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况 | |
| D. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
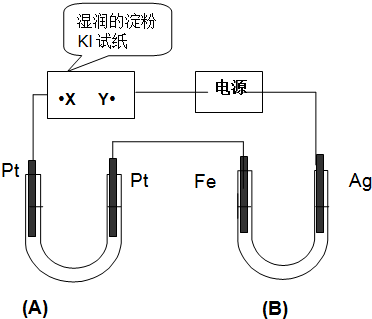
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
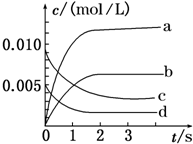 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(X)/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配置一定物质的量浓度溶液转移操作时玻璃棒下端抵在容量瓶刻度线处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com