
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
分析 A.二氧化碳和甲烷均影响地表温度;
B.乙醇和二甲醚中H的种类分别为3、1;
C.氯气与NaOH制备漂白液,计算机芯片的材料为Si;
D.醋酸与碳酸钙反应,氯化铵水解显酸性.
解答 解:A.二氧化碳和甲烷均影响地表温度,则均是造成温室效应的气体,故A正确;
B.乙醇和二甲醚中H的种类分别为3、1,则可借助于核磁共振氢谱区分,故B正确;
C.氯气与NaOH制备漂白液,漂白液的有效成分是NaClO,计算机芯片的材料为Si,而不是二氧化硅,故C错误;
D.醋酸与碳酸钙反应,氯化铵水解显酸性,则食醋可去除水垢,NH4Cl溶液可去除铁锈,故D正确;
故选C.
点评 本题考查物质的性质与用途,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意相关反应原理的应用,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
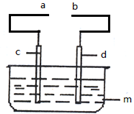 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | N2→NO→NO2→HNO3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

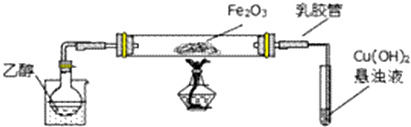
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
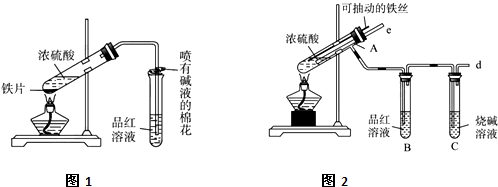
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
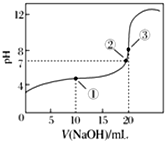 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com