
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为-33℃、沸电为114℃。某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4。
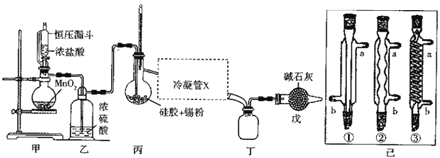
(1)装置甲中反应的离子方程式为___。整个制备装置中有一处不足,改进的方法是___。
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是___处的烧瓶,冷凝管x是已中的一种,该仪器的编号是___,装置戊的用途是___。
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是___。
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度。
①滴定时所用指示剂最好是___[假设开始出现Mn(OH)2,沉淀时的pH约为6.8]。
②假设实验时从甲中准确取出V2 mL剰余溶液并稀释到V3mL,然后用0.1000molL-1的 NaOH溶液进行滴定,滴定终点时消耗掉V1 mLNaOH溶液,则盐酸与MnO2反应时最低浓度应大于___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 甲与乙之间连一个盛有饱和食盐水的洗气瓶 甲 ① 防止空气中水份进入丁装置,同时可以吸收氯气尾气 有黄绿色气体生成 甲基橙
Mn2++Cl2↑+2H2O 甲与乙之间连一个盛有饱和食盐水的洗气瓶 甲 ① 防止空气中水份进入丁装置,同时可以吸收氯气尾气 有黄绿色气体生成 甲基橙 ![]()
【解析】
根据实验装置图可知,甲装置用MnO2和浓盐酸在加热条件下制取氯气,发生的反应为MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O,乙装置用浓硫酸干燥氯气,丙装置用锡与氯气反应生成SnCl4,为了便于生成的液态SnCl4顺利流下,应用直形冷凝管冷却,SnCl4易水解,为防止空气中水份进入丁与生成的SnCl4反应,丁后面连接一个戊装置,同时可以吸收氯气尾气,在制氯气的实验中,浓盐酸具有挥发性,加热促进挥发,所以生成的氯气中含有HCl,为防止Sn与HCl反应,在甲与乙之间还应再加一个除氯化氢的装置,即连一个盛有饱和食盐水的洗气瓶,利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂,根据氢氧化钠的物质的量可计算出V2mL剰余溶液中氯化氢的物质的量,进而可计算出此时溶液中氯化氢的物质的量浓度。
Mn2+ + Cl2↑ + 2H2O,乙装置用浓硫酸干燥氯气,丙装置用锡与氯气反应生成SnCl4,为了便于生成的液态SnCl4顺利流下,应用直形冷凝管冷却,SnCl4易水解,为防止空气中水份进入丁与生成的SnCl4反应,丁后面连接一个戊装置,同时可以吸收氯气尾气,在制氯气的实验中,浓盐酸具有挥发性,加热促进挥发,所以生成的氯气中含有HCl,为防止Sn与HCl反应,在甲与乙之间还应再加一个除氯化氢的装置,即连一个盛有饱和食盐水的洗气瓶,利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂,根据氢氧化钠的物质的量可计算出V2mL剰余溶液中氯化氢的物质的量,进而可计算出此时溶液中氯化氢的物质的量浓度。
⑴装置甲中用MnO2和浓盐酸在加热条件下制取氯气,反应的离子方程式为MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑ + 2H2O,根据上面的分析可知,整个制备装置中有一处不足,改进的方法是甲与乙之间连一个盛有饱和食盐水的洗气瓶;故答案为:MnO2 + 4H++2Cl-
Mn2+ + Cl2↑ + 2H2O,根据上面的分析可知,整个制备装置中有一处不足,改进的方法是甲与乙之间连一个盛有饱和食盐水的洗气瓶;故答案为:MnO2 + 4H++2Cl-![]() Mn2+ + Cl2↑ + 2H2O;甲与乙之间连一个盛有饱和食盐水的洗气瓶。
Mn2+ + Cl2↑ + 2H2O;甲与乙之间连一个盛有饱和食盐水的洗气瓶。
⑵由于SnCl4易水解,在实验过程中要将装置中的空气全部排尽,所以在实验时,首先加热的是甲处的烧瓶,根据上面的分析可知,冷凝管x是直形冷凝管,该仪器的编号是①,装置戊的用途是防止空气中水份进入丁装置,同时可以吸收氯气尾气;故答案为:甲;①;防止空气中水份进入丁装置,同时可以吸收氯气尾气。
⑶实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是有黄绿色气体生成;故答案为:有黄绿色气体生成。
⑷①利用标准NaOH溶液滴定甲中剩余溶液中的盐酸浓度,要防止锰离子出现沉淀,所以滴定终点的pH值要小于6.8,所以要用甲基橙做指示剂;故答案为:甲基橙。
②根据题意,NaOH的物质的量为0.1000molL-1×V1×10-3L,所以V2 mL剰余溶液中氯化氢的物质的量为0.1000molL-1×V1×10-3L,则盐酸浓度为![]() ,所以盐酸与MnO2反应时最低浓度应大于
,所以盐酸与MnO2反应时最低浓度应大于![]() ;故答案为:
;故答案为:![]() 。
。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4FeSO46H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4FeSO46H2O↓
如图为制取摩尔盐的简要流程:

请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是___。
(2)步骤②中的操作是加热蒸发、___、___。为什么不能加热蒸干___。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的___试纸、稀盐酸和___溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和___,预期的现象和结论是___。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为___。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4.0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
①本实验的指示剂是___(填字母)。
A.酚酞 B.石蕊 C.甲基橙 D.不需要
②KMnO4溶液置于______________ (填“酸式”或“碱式”)滴定管中
③滴定终点的现象是____________________________________________________。
④产品中Fe2+的百分含量是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
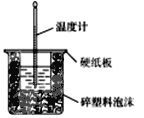
①从实验装置上看,图中尚缺少的一种玻璃用品是______。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视_____________________________________。
②在铁架台上垫一张白纸,其目的是_____________________________。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是____mol·L-1。(保留四位有效数字)
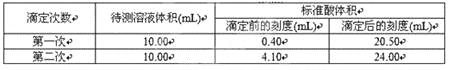
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
①Na![]() Na2O2
Na2O2![]() Na2CO3
Na2CO3
②MgO![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
③Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
④SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
⑤HCHO![]() HCOOH
HCOOH![]() HCOOCH3
HCOOCH3
A.①②③B.②③④C.②③⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。

②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com