
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H>0 |
| D、SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、9.02 g |
| B、8.51 g |
| C、8.26 g |
| D、7.04 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有化学键断裂的变化一定是化学变化 |
| B、有单质参加的化学反应一定是氧化还原反应 |
| C、pH=7的溶液一定呈中性 |
| D、c(H+)=c(OH-)的溶液一定是中性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
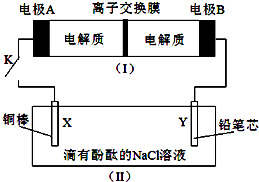 如图所示装置(I)是一种可充电电池的示意图,其中的离子交换膜只允许Na+通过,该电池放电、充电的化学方程式为:2Na2S2+NaBr3
如图所示装置(I)是一种可充电电池的示意图,其中的离子交换膜只允许Na+通过,该电池放电、充电的化学方程式为:2Na2S2+NaBr3| 放电 |
| 充电 |
| A、电池充电时,电极A连接直流电源的负极 |
| B、电池放电过程中Na+从左到右通过离子交换膜 |
| C、闭合开关K后,电极X附近的pH变小 |
| D、闭合开关K后,当有0.1 mol Na+通过离子交换膜,电极Y上产生1.12 L气体(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 单质是热和电的良导体,熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体. |
| B | 原子核外有7种运动状态不同的电子 |
| C | 单质常温、常压下是气体,原子的L层有一个未成对的p电子. |
| D | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④①②⑤③ |
| B、④①②⑤③ |
| C、①④⑤③② |
| D、①④②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol锌粒与足量盐酸反应产生11.2 L H2 |
| B、标准状况下,11.2 L CCl4所含分子数为0.5NA |
| C、0.1 mol CH4所含氢原子数为0.4NA |
| D、常温常压下,28 g N2中所含原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
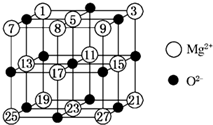 镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com