
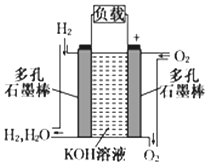
 被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:分析 (1)氢氧燃料电池中,通入燃料的电极是负极;
(2)氢氧燃料电池电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子;
(3)根据电极方程式中电子与氧气的关系求算;
(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇燃烧生成碳酸根离子.
解答 解:(1)氢氧燃料电池中,通入燃料的电极是负极,即氢气进入的电极是负极,
故答案为:负极;
(2)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(3)根据电极反应O2+2H2O+4e-=4OH-可知转移4mol电子时,消耗氧气1mol,则每转移0.3mol电子消耗的氧气为:$\frac{1}{4}$×0.3mol=0.075mol,则V(O 2)=nVm=0.075mol×22.4L/mol=1.68L,
故答案为:1.68;
(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇在负极燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
点评 本题考查燃料电池及物质的量的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理以及根据电极方程式中电子与物质的关系求算,题目难度中等.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,溶液中的OH-由负极向正极移动 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
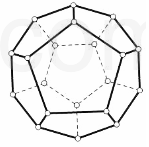 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| B. | 尼泊金酸与碳酸氢钠反应: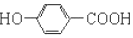 +2HCO3-→ +2HCO3-→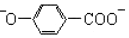 +2CO2↑+2H2O +2CO2↑+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]++2OH$\stackrel{△}{→}$CO32-+2NH4++2Ag↓+2NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
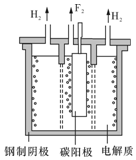 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48L Cl2溶于水所得氯水中含氯的微粒总数为0.4NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com