
【题目】下列关于有机化合物 ![]() 和
和 ![]() 的说法正确的是( )
的说法正确的是( )
A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D. ![]() 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯结构简式为______________________。
(2)![]() 系统命名为___________________________。
系统命名为___________________________。
(3)![]() 的系统命名___________。
的系统命名___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机化学反应的化学方程式。
(1)乙烯通入溴的四氯化碳溶液中:_____________。
(2)苯、浓硫酸与浓硝酸混合在50-60℃的水浴中加热:________。
(3)乙醇在铜作催化剂、加热的条件下与氧气的反应:__________。
(4)乙酸乙酯与氢氧化钠溶液反应:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如图所示,仪器A的名称是_______________;
(2)NaOH溶液稍过量的原因 ______________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 _________________________。
(5)实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
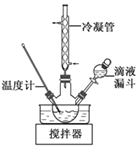
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如图。已知甲、乙两室中气体的质量之差为10.9g。

(1)甲室中气体的物质的量为____mol
(2)甲室中气体的质量为____g
(3)甲室中NH3、H2的平均相对分子质量为___。
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“___”处(填数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50mL KMnO4标准溶液的过程示意图。


(1)请你观察图示判断,其中不正确的操作有__________(填序号)。
(2)如果用图示的操作配制溶液,所配制的溶液浓度将__________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=__________。
(4)经过计算,血液样品中Ca2+的浓度为__________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L(标准状况下)某气态烃,完全燃烧生成的CO2和水蒸气在273 ℃、1.01×105 Pa下体积为y L,当冷却至标准状况时体积为x L。下列用x、y表示该烃的化学式正确的是
A. CxHy-2x B. CxHy-x C. CxH2y-2x D. CxHy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇、乙酸、浓硫酸制备乙酸乙酯,装置如图所示。下列说法正确的是

A. 边加热边蒸出是为得到纯净产物
B. 长导管的作用是导气、冷凝、回流
C. 小试管内盛放NaOH溶液,为除去产物中的乙酸
D. 浓H2SO4既加快反应速率又提高反应转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com