
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
分析 A.卤素单质都是分子晶体,其熔沸点随着相对分子质量增大而增大;
B.卤单质氧化性越强,对应离子的还原越弱;
C.主族元素中,其最高正化合价与其族序数相等,但O、F元素没有正化合价;
D.元素的非金属性越强,其单质的氧化性越强.
解答 解:A.卤素单质都是分子晶体,其熔沸点随着相对分子质量增大而增大,卤族元素中随着原子序数增大其分子的相对分子质量增大,所以其熔沸点逐渐升高,故A错误;
B.卤族元素中,随着原子序数增大元素非金属性逐渐减弱,所以其单质的氧化性逐渐减弱,所以卤素离子的还原性逐渐增强,故B正确;
C.主族元素中,其最高正化合价与其族序数相等,但O、F元素没有正化合价,卤族元素中其最高正化合价都是+7(F元素除外),故C错误;
D.元素的非金属性越强,其单质的氧化性越强,卤族元素中,随着原子序数增大元素非金属性逐渐减弱,所以其单质的氧化性逐渐减弱,故D错误;
故选B.
点评 本题考查同一主族元素性质递变规律,为高考高频点,熟练掌握碱金属族、卤族元素及第三周期元素原子结构及其性质递变规律,注意规律中的特殊现象,易错选项是C.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
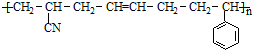 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和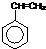 (写结构简式).
(写结构简式).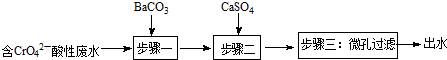
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com