
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、0.5NA个氯分子所占体积约为11.2L |
| C、28g氮气所含原子数为2NA |
| D、18g水所含的质子总数为10NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、装置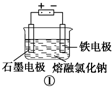 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 |
B、装置 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 |
C、装置 中的离子交换膜只允许阳离子、阴离子和小分子水通过 中的离子交换膜只允许阳离子、阴离子和小分子水通过 |
D、装置 的待镀铁制品应与电源正极相连 的待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、③④⑤ |
| C、②③④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、E是一种非金属元素 |
| B、在ECln中E与Cl之间形成共价键 |
| C、E的一种常见氧化物为EO |
| D、E位于元素周期表的ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体与硅酸溶液混合将产生凝聚现象 |
| B、Fe(OH)3胶体粒子在电场影响下将向阳极移动 |
| C、液溶胶中Fe(OH)3胶体粒子不停地做布朗运动 |
| D、光线通过Fe(OH)3胶体时会发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g硫在足量的O2中燃烧生成的SO3分子数等于NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、常温常压下,25g甲醛所含电子数为10NA |
| D、在标准状态下,68g H2O2中含有的6mol共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com