
分析 常用的物质分离的方法:过滤、萃取、分液、蒸馏、分馏等,结合实验中的仪器分析.
解答 解:①漏斗漏斗可用于过滤,过滤是一种分离混合物的方法,故①正确;
②容量瓶是配制一定物质的量浓度的溶液的仪器,故②错误;
③蒸馏烧瓶是用于蒸馏实验的容器,蒸馏是一种分离物质的方法,故③正确;
④天平是称量药品质量的仪器,故④错误;
⑤分液漏斗是分离互不相溶的密度不同的液体的仪器,故⑤正确;
⑥滴定管是用来两取溶液的体积和滴定操作,故⑥错误;
⑦燃烧匙是做物质燃烧实验用的仪器,故⑦错误;
故答案为:①③⑤.
点评 本题考查混合物分离提纯实验中的仪器,为高频考点,把握混合物分离提纯实验及仪器的使用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
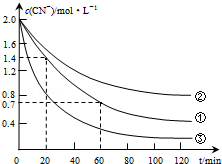
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | K+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
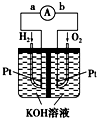 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ④ | C. | ②⑤ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气能使湿润的蓝色石蕊试纸变红 | B. | 氨气极易溶于水,水溶液呈碱性 | ||
| C. | 氨和盐酸相遇能产生白烟 | D. | 氨水不稳定,受热易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com