
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
分析 A.苯和溴水不反应,和液溴在溴化铁作催化剂条件下反应;
B.银镜反应需要水浴加热;
C.碱应过量,反应在碱性条件下进行;
D.苯酚和浓溴水发生取代反应.
解答 解:A.苯和溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,故A错误
B.银镜反应要在水浴加热的条件下,将乙醛滴入银氨溶液中,加热煮沸得到黑色沉淀,故B错误;
C.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后恰好反应生成氢氧化铜,碱应过量,故C错误
D.苯酚和浓溴水发生取代反应生成三溴苯酚白色沉淀,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、物质检验等知识点,明确实验原理、物质性质及实验条件是解本题关键,注意把握相关实验的注意事项以及相关物质的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
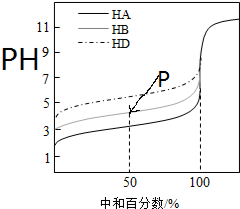 下列判断错误的是( )
下列判断错误的是( )| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| B. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| C. | 利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3 | |
| D. | 研究发现出土的青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
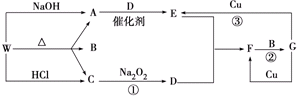
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
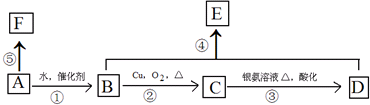
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 约-40℃ | B. | 低于-162℃ | C. | 低于-89℃ | D. | 高于36℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
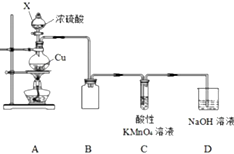 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
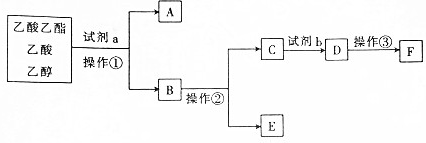
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com