
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
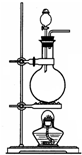 如图是实验室制 Cl2 的装置图.
如图是实验室制 Cl2 的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
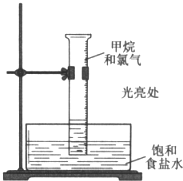 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )| 现象 | 解释 | |
| A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
| B. | 量筒内出现少量白雾 | 生成HCl气体 |
| C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
| D. | 量筒中液面降低 | 生成液态产物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
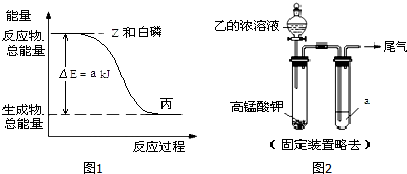
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com