
【题目】A~G是几种烃的分子球棍模型(如图) 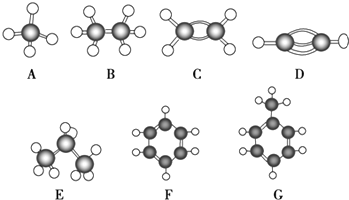
据此回答下列问题:
(1)常温下含碳量最高的气态烃是(填对应字母).
(2)能够发生加成反应的烃有(填数字)种.
(3)一卤代物种类最多的是(填对应字母) .
(4)写出实验室制取C的化学方程式 .
(5)写出F发生溴代反应的化学方程式 .
【答案】
(1)D
(2)4
(3)G
(4)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(5)C6H6+Br2 ![]() C6H5Br+HBr
C6H5Br+HBr
【解析】解:有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,(1)常温下含碳量最高的气态烃是乙炔,故答案为:D;(2)能够发生加成的烃有有乙烯、乙炔、苯和甲苯4种,故答案为:4;(3)一卤代物种类最多的是甲苯,共有4种,故答案为:G;(4)D为乙烯,实验室用乙醇和浓硫酸在170℃制备,反应的方程式为CH3CH2OH ![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH ![]() CH2=CH2↑+H2O;(5)F为苯,可与溴发生取代反应,反应的方程式为C6H6+Br2
CH2=CH2↑+H2O;(5)F为苯,可与溴发生取代反应,反应的方程式为C6H6+Br2 ![]() C6H5Br+HBr,
C6H5Br+HBr,
故答案为:C6H6+Br2 ![]() C6H5Br+HBr.
C6H5Br+HBr.
有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,根据物质的组成、结构和性质解答该题.


科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图: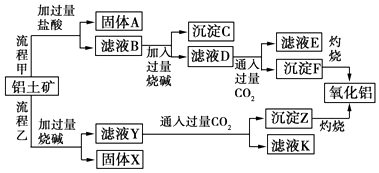
请回答下列问题:
(1)写出流程甲所涉及的离子方程式为、、 .
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 .
(3)沉淀C的主要成分是 , 除去沉淀C的操作是 .
(4)滤液D中溶质的主要成分是(填化学式);写出向滤液D中通入过量CO2发生反应的离子方程式 .
(5)在流程中,选用CO2作酸化剂,能不能用盐酸代替CO2 ?其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫酸反应,转移电子数目为0.2NA
D.常温下,1 L 1 molL﹣1的CH3COOH溶液中,所含溶质分子数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示: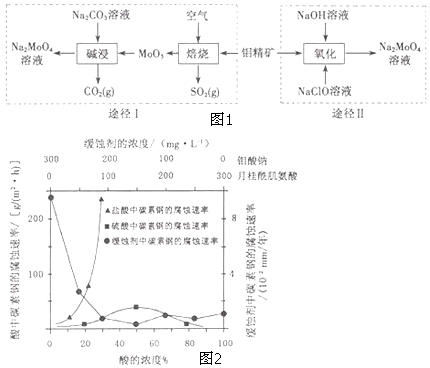
(1)NaClO的电子式是 .
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 .
(3)途径I碱浸时发生反应的离子方程式为 .
(4)途径Ⅱ氧化时发生反应的离子方程式为 .
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 .
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 .
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某气体A的密度是1.25 g·L-1,则它的摩尔质量是________;该气体在相同温度和压强下其相对于氢气的密度是______。若该气体是单质,同质量的A与氧气所含的分子数之比为_______________。
(2)某物质的相对分子质量为M,在温度为T时的溶解度为S g,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液中该物质的物质的量浓度为_______(用代数式表示)。
(3)现实验室要用质量分数为40%的浓氢氧化钠(密度为1.2 g·mL-1)来配制浓度为0.6 mol·L-1的稀氢氧化钠100 mL,问需要这种浓碱的体积是______ mL。
(4)下列有关实验操作或判断不正确的是________。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸并搅拌
D.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
E.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(1)在光照条件下,氯气和氢气反应过程如下: ①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
(2)已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.
(3)卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是(填字母).
A.卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高
B.原子半径按
C.Cl、Br、I的顺序由大到小
D.卤化氢的稳定性按的H
E.HCl、HBr、HI的顺序由强到弱
F.卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易
(4)碘单质及其化合物具有重要应用.下列说法正确的是(填字母). a. ![]() I与
I与 ![]() I互为同位素
I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)【观察与思考】 乙醇分子的核磁共振氢谱有个吸收峰.
(2)【活动与探究】 (i)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满).
实验现象 | 结 论 | |
① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
② |
(ii)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) . 欲验证此实验的有机产物,可以将产物加入盛有的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为 .
(3)【交流与讨论】 丙同学向一支试管中加入3mL 乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按下图所示连接好装置,请指出该装置的主要错误是 . 假如乙醇分子中的氧原子为18O原子,则发生此反应后,18O原子将出现在生成物中(填字母).
A.水 B.乙酸乙酯 C.水和乙酸乙酯.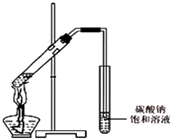
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取10.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20molL ﹣1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.50mL | 18.60mL |
第二次 | 0.70mL | 19.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 . A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名的医学家宋慈《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag + 2H2S + O2![]() 2X(黑色)+ 2H2O,下列说法中,不正确的是
2X(黑色)+ 2H2O,下列说法中,不正确的是
A. 银针验毒时,空气中的氧气得到电子
B. 每生成1molX,反应转移2mole-
C. 氧化剂和还原剂的物质的量之比为1: 4
D. 反应中Ag和H2S均为还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com