
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| c(HClO)?c(OH-) |
| c(ClO-) |
| c(HClO)?c(OH-) |
| c(ClO-) |
| c(HClO)?c(OH-) |
| c(ClO-) |
| ||
| ||


科目:高中化学 来源: 题型:
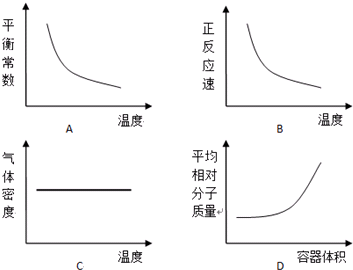
| A、对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大 |
| B、一定温度下,在a mol?L-1的饱和石灰水中加入适量的b mol?L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出 |
| C、相同温度时,CH3COOH的电离平衡常数Ka与NH3?H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性 |
| D、升高温度,以上常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
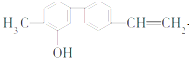
| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol | 放出的热量/kJ |
| 0 | 1.20 | 0.60 | 0 |
| t1 | 0.80 | Q | |
| t2 | 0.20 |
| CO | H2O | CO2 | H2 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0 | 0 |
| 平衡浓度(mol/L) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
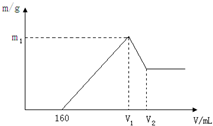 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 ).M的一条合成路线如下(部分反应试剂和条件省略).
).M的一条合成路线如下(部分反应试剂和条件省略).
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
 与
与 的化学性质相似.
的化学性质相似.查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com